题目内容
12.分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且生成酸和醇的物质的量之比为1:2,则符合该条件的有机物有(不考虑立体异构)( )| A. | 8种 | B. | 10种 | C. | 12种 | D. | 13种 |
分析 酯类水解得到羧酸和醇,由题意得出水解生成酸和醇的物质的量之比为1:2,那么该羧酸应为二元羧酸,据此分析即可.
解答 解:该有机物的不饱和度为:$\frac{8×2+2-14}{2}$=2,又知酸和醇的物质的量之比为1:2,那么除酯基以外的烃基应为饱和烃基,
若酸为乙二酸,那么剩余为丙基,丙基有2种,故此酯有2种;
若酸为丁二酸,剩余为乙基,丁二酸有2种,故此酯类有2种;
若酸为己二酸,剩余为甲基,己二酸有9种,故此酯有9种,故总共为2+2+9=13种,故选D.
点评 本题主要考查的是酯类水解的规律,涉及同分异构体个数的判断,熟练掌握C原子数小于5的烃基的个数是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是( )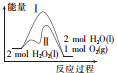

| A. | 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰 | |
| B. | 2 molH2O2(l)的能量高于2 molH2O(l)的能量 | |
| C. | 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ | |
| D. | 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ |
20. 短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
 短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中相对位置如图所示,Y元素在地壳中的含量最高.下列说法正确的是( )| A. | 原子半径:Z<Y<W | |
| B. | 最简单气态氢化物的热稳定性:Y<W | |
| C. | 含X的化合物形成的溶液一定呈酸性 | |
| D. | Y的最简单阴离子和Z的最简单阳离子核外电子数相同 |
7.瑞典皇家科学院宣布,包括美籍华裔科学家钱永健在内的3名科学家获得2008年度诺贝尔化学奖,帮助他们获奖的是能发出鲜艳绿光的绿色银光蛋白GFP,下列对GFP结构和性质的预测不正确的是( )
| A. | GFP可以溶于水,且其水溶液可以通过滤纸 | |
| B. | 为了防止GFP变质,可以培养在福尔马林溶液中 | |
| C. | GFP在一定条件下会发生水解,且水解产物一定只有α-氨基酸 | |
| D. | 灼烧GFP会产生烧焦羽毛的气味 |
17.某无色溶液中只可能含有Na+、Ba2+、Cl-、Br-、SO32-、SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4震荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 肯定含有的离子是Na+、Br-、SO32- | B. | 肯定没有的离子是Ba2+、SO32- | ||
| C. | 可能含有的离子是Cl-、Br-、SO42- | D. | 不能确定的离子是Cl-、SO42- |
6.下列结论错误的是( )
| A. | 氧化性:F2>Cl2>S | B. | 稳定性:HF>HCl>H2S>PH3 | ||
| C. | 离子半径:K+>Al3+>S2->Cl- | D. | 酸性:HClO4>H2SO4>H3PO4>HClO |
7.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温下,46g NO2和N2O4含有2nA个氧原子 | |
| B. | 1mol Na在空气中燃烧,转移2nA个电子 | |
| C. | 1L0.1mol•L-1CH3COOH溶液中含有0.1nA个H+ | |
| D. | 标况下,22.4LHF中含有nA个HF分子 |