题目内容
8.有X、Y、Z、W 四种含14个电子的粒子,其结构特点如下:| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
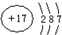 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024(2)Z与钙离子组成的化合物的电子式为
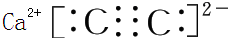
(3)28g Y 完全燃烧放出的热量是283.0kJ,写出 Y 燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙
①写出丁在高温下与水反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
②组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
分析 X、Y、Z、W 四种含14个电子的粒子,X是单核粒子,电荷数为0,所以为原子,则X为Si;
Y是不同元素构成的两核电子,电荷数为0,所以为分子,为CO;
Z是同种元素构成的两核微粒,带电荷电荷负电荷,则Z为C22-;
W是同种元素构成的两核,粒子所带电荷数是0,为N2;
(1)A 原子核外比 X 原子多3个电子,则A是Cl元素,Cl原子核外有17个电子,有3个电子层;
二氧化硅晶体中每个Si原子含有四个Si-O键;
(2)Z与钙离子组成的化合物为CaC2,碳化钙电子式为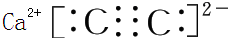 ;
;
(3)Y是CO,28gCO的物质的量是1mol,1molCO 完全燃烧放出的热量是283.0kJ,则2molCO完全燃烧放出566.0kJ热量,据此书写燃烧的热化学方程式;
(4)组成W的元素最高价氧化物对应的水化物甲为硝酸,硝酸和丁反应生成乙,乙能和丁反应生成丙,硝酸具有强氧化性,则丁为C,乙为CO2、丙为CO,丁也可以是Fe,则乙为Fe(NO3)3、丙为Fe(NO3)2
①C在高温下与水反应生成CO和氢气,Fe和水蒸气在高温下反应生成四氧化三铁和氢气;
②组成W的元素的简单氢化物是氨气,能形成分子间氢键的物质极易溶于水,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,负极上通入氨气,氨气失电子和氢氧根离子反应生成氮气和水.
解答 解:X、Y、Z、W 四种含14个电子的粒子,X是单核粒子,电荷数为0,所以为原子,则X为Si;
Y是不同元素构成的两核电子,电荷数为0,所以为分子,为CO;
Z是同种元素构成的两核微粒,带电荷电荷负电荷,则Z为C22-;
W是同种元素构成的两核,粒子所带电荷数是0,为N2;
(1)A 原子核外比 X 原子多3个电子,则A是Cl元素,Cl原子核外有17个电子,有3个电子层,原子结构示意图为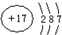 ;
;
二氧化硅晶体中每个Si原子含有四个Si-O键,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024,
故答案为: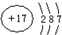 ;4NA或2.408×1024;
;4NA或2.408×1024;
(2)Z与钙离子组成的化合物为CaC2,碳化钙电子式为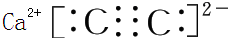 ,
,
故答案为: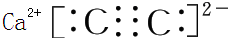 ;
;
(3)Y是CO,28gCO的物质的量是1mol,1molCO 完全燃烧放出的热量是283.0kJ,则2molCO完全燃烧放出566.0kJ热量,燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g);△H=-566.0 kJ/mol,
故答案为:2CO(g)+O2(g)=2CO2(g);△H=-566.0 kJ/mol;
(4)组成W的元素最高价氧化物对应的水化物甲为硝酸,硝酸和丁反应生成乙,乙能和丁反应生成丙,硝酸具有强氧化性,则丁为C,乙为CO2、丙为CO,丁也可以是Fe,则乙为Fe(NO3)3、丙为Fe(NO3)2,
①Fe和水蒸气在高温下反应生成四氧化三铁和氢气,C在高温下与水反应生成CO和氢气,反应方程式分别为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
②组成W的元素的简单氢化物是氨气,能形成分子间氢键的物质极易溶于水,氨气和水之间易形成氢键而导致氨气极易溶于水;
该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,负极上通入氨气,氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:NH3与H2O间能形成氢键;2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及原电池原理、氢键、热化学反应方程式的书写、物质结构等知识点,综合性较强,侧重考查基本原理及物质结构,难点是燃料电池电极反应式的书写.

| A. | SO3与HCHO | B. | BF3与NH3 | C. | BeCl2与SCl2 | D. | H2O与SO2 |
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 二氧化氯(ClO2) |
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBr的稳定性比HI强 |
| A. | 沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 等物质的量的物质完全燃烧时耗O2量:乙烷>乙烯>甲烷 | |
| D. | 等质量的物质完全燃烧时耗O2量:甲烷>乙烷>乙烯>乙炔 |
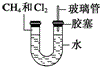 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.