题目内容
16.已知反应:5NH4NO3═2HNO3+4N2↑+9H2O.问:当反应生成4molN2时,电子转移15mol,同时被氧化与被还原的氮原子的质量比为5:3.分析 在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为氮气中0价,被氧化;由硝酸根中+5价降低为氮气中0价,被还原,氮气既是还原产物也是氧化产物,根据电子转移守恒,计算被氧化的氮原子与被还原的氮原子物质的量之比,计算被氧化的N原子物质的量,结合化合价比变化计算转移电子物质的量.
解答 解:在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为氮气中0价,被氧化;由硝酸根中+5价降低为氮气中0价,被还原,氮气既是还原产物也是氧化产物,根据电子转移守恒,可知被氧化的氮原子与被还原的氮原子物质的量之比为(5-0):[0-(-3)]=5:3,当反应生成4molN2时,被氧化的N原子为4mol×2×$\frac{5}{8}$=5mol,故转移电子物质的量为5mol×[0-(-3)]=15mol,
故答案为:15;5:3.
点评 本题考查氧化还原反应计算,注意根据化合价理解基本概念,注意电子转移守恒运用.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
6. 近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )
近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )
 近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )
近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构如图所示,下列相关说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 苹果酸在一定条件下能发生消去反应 | |
| D. | 1 mol苹果酸与Na反应必须消耗2 mol Na |
7.下列溶液中的各组离子,一定能够大量共存的是( )
| A. | pH=3的无色溶液:Na+、Cl-、Fe2+、ClO- | |
| B. | 使石蕊溶液变红的溶液:Na+、Cl-、SO42-、AlO2- | |
| C. | 与Al产生H2的溶液:K+、SO42-、CO32-、NH4+ | |
| D. | 水电离的c(H+)=1×10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- |
4.NH4H与NH4 Cl的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水,所形成的溶液显酸性 | |
| C. | NH4H与水反应时,NH4H是还原剂 | |
| D. | NH4H固体投入少量的水中,有两种气体生成 |
7.甲烷与氯气以物质的量之比1:4混合,在光照下得到的产物:①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4,其中正确的是( )
| A. | 只有① | B. | 只有② | C. | ①②③的混合物 | D. | ①②③④的混合物 |
8.有X、Y、Z、W 四种含14个电子的粒子,其结构特点如下:
(1)A 原子核外比 X 原子多3个电子,A 的原子结构示意图是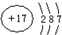 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
(2)Z与钙离子组成的化合物的电子式为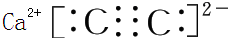
(3)28g Y 完全燃烧放出的热量是283.0kJ,写出 Y 燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙
①写出丁在高温下与水反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
②组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
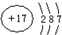 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024(2)Z与钙离子组成的化合物的电子式为
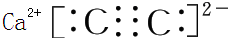
(3)28g Y 完全燃烧放出的热量是283.0kJ,写出 Y 燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙
①写出丁在高温下与水反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
②组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
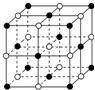 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知: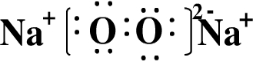 ,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.