题目内容
19.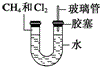 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl.
(2)若题目中甲烷与氯气的体积比为1:1,则得到的产物为D.
A.CH3Cl HCl
B.CCl4 HCl
C.CH3Cl CH2Cl2
D.CH3Cl CH2Cl2 CHCl3 CCl4 HCl
(3)经过几个小时的反应后,U形管右端的水柱变化是B.
A.升高 B.降低 C.不变 D.无法确定
(4)右端玻璃管的作用是平衡气压.
分析 (1)根据甲烷和氯气发生取代反应的实质来回答判断;
(2)甲烷和氯气在光照条件下发生取代反应,甲烷的取代反应为逐步取代,但是多步取代反应是同时进行的,据此进行判断;
(3)根据大气压强原理来判断U型管右端的玻璃管中水柱变化;
(4)右端玻璃管和大气相通,可平衡压强.
解答 解:(1)甲烷中的氢原子可以被氯原子取代,甲烷与氯气反应充分,且只产生一种有机物即四氯化碳的化学方程式为:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl,
故答案为:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl;
(2)甲烷和氯气在光照条件下发生逐步取代反应,但是多步取代反应是同时进行飞,所有得到的产物与甲烷和氯气的物质的量之比无关,故得到的产物为:CH3Cl、CH2Cl2、CHCl3、CCl4、HCl,则D正确,
故答案为:D;
(3)经过几个小时的反应后,消耗氯气,反应中气体的物质的量减少,所以压强减小,且生成的HCl能够溶解于水,U型管右端的玻璃管中水柱降低;
故答案为:B;
(4)右端玻璃管和大气相通,可平衡气压,
故答案为:平衡气压.
点评 本题考查了甲烷的性质,题目难度不大,明确甲烷和氯气发生取代生成一系列取代产物,分析现象时抓住生成物的性质特征,注意平时知识的积累是解题的关键.

练习册系列答案
相关题目
7.下列溶液中的各组离子,一定能够大量共存的是( )
| A. | pH=3的无色溶液:Na+、Cl-、Fe2+、ClO- | |
| B. | 使石蕊溶液变红的溶液:Na+、Cl-、SO42-、AlO2- | |
| C. | 与Al产生H2的溶液:K+、SO42-、CO32-、NH4+ | |
| D. | 水电离的c(H+)=1×10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- |
7.甲烷与氯气以物质的量之比1:4混合,在光照下得到的产物:①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4,其中正确的是( )
| A. | 只有① | B. | 只有② | C. | ①②③的混合物 | D. | ①②③④的混合物 |
14.分别向下列各溶液中加入少量NaOH固体,溶液的导电能力变化最小的是( )
| A. | 水 | B. | 盐酸 | C. | 醋酸溶液 | D. | NaCl溶液 |
4.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知:
①a、c、e皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
①a、c、e皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
11.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为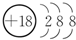 .
.
(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
8.有X、Y、Z、W 四种含14个电子的粒子,其结构特点如下:
(1)A 原子核外比 X 原子多3个电子,A 的原子结构示意图是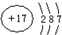 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
(2)Z与钙离子组成的化合物的电子式为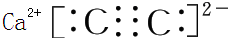
(3)28g Y 完全燃烧放出的热量是283.0kJ,写出 Y 燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙
①写出丁在高温下与水反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
②组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
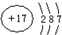 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024(2)Z与钙离子组成的化合物的电子式为
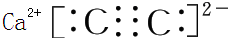
(3)28g Y 完全燃烧放出的热量是283.0kJ,写出 Y 燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙
①写出丁在高温下与水反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
②组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 .
.