题目内容
16.下列分子中的中心原子杂化轨道的类型相同的是( )| A. | SO3与HCHO | B. | BF3与NH3 | C. | BeCl2与SCl2 | D. | H2O与SO2 |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
解答 解:A.三氧化硫分子中S原子价层电子对个数=3+$\frac{1}{2}$×(6-3×2)=3,所以采用sp2杂化;甲醛分子中C原子价层电子对个数是3+$\frac{1}{2}$×(4-1×2-2×1)=3,所以采用sp2杂化,为sp2杂化,二者杂化类型相同,故A正确;
B.BF3中B原子价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3,所以采用sp2杂化;NH3中N原子价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,所以采用sp3杂化,二者杂化方式不同,故B错误;
C.氯化铍中Be原子价层电子对个数=2+$\frac{1}{2}$×(2-2×1)=2,所以采用sp杂化;二氯化硫中S原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以采用sp3杂化,二者杂化方式不同,故C错误;
D.水分子中O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以采用sp3杂化;二氧化硫中S原子价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3,所以采用sp2杂化,二者杂化方式不同,故D错误;
故选A.
点评 本题考查原子杂化方式判断,为高频考点,明确价层电子对互斥理论即可解答,难点是孤电子对计算方法.

练习册系列答案
相关题目
4.NH4H与NH4 Cl的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水,所形成的溶液显酸性 | |
| C. | NH4H与水反应时,NH4H是还原剂 | |
| D. | NH4H固体投入少量的水中,有两种气体生成 |
7.甲烷与氯气以物质的量之比1:4混合,在光照下得到的产物:①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4,其中正确的是( )
| A. | 只有① | B. | 只有② | C. | ①②③的混合物 | D. | ①②③④的混合物 |
4.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知:
①a、c、e皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
①a、c、e皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
11.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为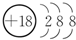 .
.
(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
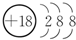 .
.(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
1.下列各组有机物中,其一氯代物的数目不相等的是( )
| A. | 正戊烷和正己烷 | B. | 苯和乙烷 | ||
| C. | 对二甲苯和2,2-二甲基丙烷 | D. | 甲苯和2-甲基丁烷 |
8.有X、Y、Z、W 四种含14个电子的粒子,其结构特点如下:
(1)A 原子核外比 X 原子多3个电子,A 的原子结构示意图是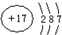 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
(2)Z与钙离子组成的化合物的电子式为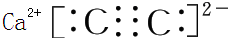
(3)28g Y 完全燃烧放出的热量是283.0kJ,写出 Y 燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙
①写出丁在高温下与水反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
②组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
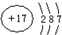 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024(2)Z与钙离子组成的化合物的电子式为
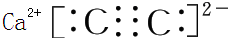
(3)28g Y 完全燃烧放出的热量是283.0kJ,写出 Y 燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙
①写出丁在高温下与水反应的化学方程式3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2或C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2
②组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
5. 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型.如图,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型.如图,下列说法中不正确的是( )
 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型.如图,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型.如图,下列说法中不正确的是( )| A. | 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多 | |
| B. | 分子中碳原子的化学环境有2种 | |
| C. | 分子中的氢原子分布在两个相互垂直的直线上 | |
| D. | 分子中有C-C键,也有C=C |
6.乙酸乙酯在NaOH的重水(D2O)溶液中加热水解,其产物是( )
| A. | CH3COOD,C2H5OD | B. | CH3COONa,C2H5OD,HOD | ||
| C. | CH3COONa,C2H5OH,HOD | D. | CH3COONa,C2H5OD,H2O |