题目内容
14.氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水分解,其制取过程的相关反应如下:S(s)+Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$ SCl2(l) (Ⅰ)
SCl2(l)+SO3(l)═SOCl2(l)+SO2(g)(Ⅱ)
已知二氯化硫(SCl2)熔点-78°C,沸点59°C,如图是实验室由氯气与硫合成二氯化硫的装置.

(1)仪器组装完成后,首先进行的一步操作是检查装置气密性;反应前要先排尽系统中空气,此做法目的是防止加热硫粉时,空气中的氧气与硫粉反应.
(2)装置B盛放的药品是饱和氯化钠溶液,装置D中玻璃仪器的名称是蒸馏烧瓶,向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是增大反应物接触面积,使反应更加充分.
(3)实验时,为防止E中液体挥发,可采取的措施是将锥形瓶放入冰水中冷却.装置F(盛放碱石灰)有两个作用:一是吸收多余的氯气,另一个是防止空气中水蒸气进入.
(4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使三种原料恰好完全反应,三者的物质的量比为1:1:1;氯化亚砜遇水易分解,请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成.
已知:SOCl2+4NaOH=Na2SO3+2NaCl+2H2O
供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液.
分析 装置A制备氯气,装置B吸收氯气的中HCl,装置C干燥氯气,D装置生成SCl2,E装置收集SCl2,F装置吸收多余的氯气,吸收空气中水蒸气,防止进入E中.
(1)制备气体,装置气密性要好;加热硫粉时,空气中的氧气能与硫粉反应;
(2)用饱和氯化钠溶液吸收HCl;由仪器5的特征,可知为蒸馏烧瓶;增大反应物接触面积;
(3)二氯化硫(SCl2)的沸点低,易挥发,可以用冰水冷却;防止空气中水蒸气进入;
(4)根据方程式判断硫黄、液氯和液体三氧化硫的物质的量之比;
由SOCl2与氢氧化钠溶液反应可知,SOCl2水解后分解得到SO2、HCl,利用品红溶液检验有二氧化硫生成,用硝酸银溶液检验氯离子.
解答 解:装置A制备氯气,装置B吸收氯气的中HCl,装置C干燥氯气,D装置生成SCl2,E装置收集SCl2,F装置吸收多余的氯气,吸收空气中水蒸气,防止进入E中.
(1)仪器组装完成后,首先进行的一步操作是:检查装置气密性;加热硫粉时,空气中的氧气与硫粉反应,应先排尽系统中空气,
故答案为:检查装置气密性;防止加热硫粉时,空气中的氧气与硫粉反应;
(2)B装置吸收氯气中的HCl,用饱和氯化钠溶液反应吸收;由仪器5的特征,可知为蒸馏烧瓶;热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,可以增大反应物接触面积,使反应更加充分,
故答案为:饱和氯化钠溶液;蒸馏烧瓶;增大反应物接触面积,使反应更加充分;
(3)二氯化硫(SCl2)的沸点低,为防止SCl2中液体挥发,可采取将锥形瓶放入冰水中冷却等措施,装置F(盛放碱石灰)有两个作用:一是吸收多余的氯气,另一个是:防止空气中水蒸气进入,
故答案为:将锥形瓶放入冰水中冷却;防止空气中水蒸气进入;
(4)由S(s)+Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$ SCl2(l)、SCl2(l)+SO3(l)═SOCl2(l)+SO2(g)可知硫黄、液氯和液体三氧化硫的物质的量之比为1:1:1;
由SOCl2与氢氧化钠溶液反应可知,SOCl2水解后分解得到SO2、HCl,利用品红溶液检验有二氧化硫生成,用硝酸银溶液检验氯离子,具体实验操作为:分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成,
故答案为:1:1:1;分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成.
点评 本题考查化学实验制备方案,涉及基本操作、对操作与装置的分析评价、物质检验等,较好的考查学生对知识的迁移运用能力,难度中等.

 天天练口算系列答案
天天练口算系列答案| A. | 1molCnH2n+2中含有的C-C键数为(n-1)NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.5 NA |
| A. | 质子数为17、中子数为20的氯原子${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: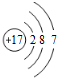 | |
| C. | 氯分子的电子式: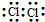 | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
| A. | 使用LED照明灯属于“低碳生活”方式 | |
| B. | 研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生 | |
| C. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被侵蚀 | |
| D. | 施用适量石灰乳可降低盐碱地(含较多NaCl,Na2CO3)的碱性 |
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含所有FeCl3 |
| B | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}}{→}$NaOH | 用生石灰制备NaOH溶液 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2NaOH(足量)-Na2HPO3+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
 已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3
已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示. (1)金刚石和石墨的晶胞如图,若碳原子半径为a cm 且相邻最近的碳原子相切,阿伏加德罗常数为NA,则金刚石的密度表达式为(要求整理为分母不含根号的表达式)$\frac{9\sqrt{3}}{1{6a}^{3}{N}_{A}}$g/cm3,一个石墨晶胞内含有4个碳原子,石墨的熔点比金刚石的熔点要高,其原因是石墨中碳碳键长小于金刚石中碳碳键长,这两种晶胞中碳的配位数(每个碳周围与之最近的碳原子数)之比为4:3.
(1)金刚石和石墨的晶胞如图,若碳原子半径为a cm 且相邻最近的碳原子相切,阿伏加德罗常数为NA,则金刚石的密度表达式为(要求整理为分母不含根号的表达式)$\frac{9\sqrt{3}}{1{6a}^{3}{N}_{A}}$g/cm3,一个石墨晶胞内含有4个碳原子,石墨的熔点比金刚石的熔点要高,其原因是石墨中碳碳键长小于金刚石中碳碳键长,这两种晶胞中碳的配位数(每个碳周围与之最近的碳原子数)之比为4:3.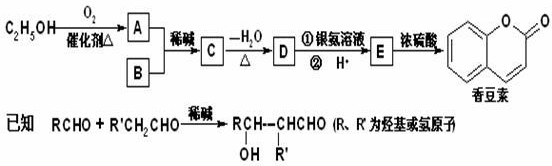
 ;
; ;
;  ;
;  ;
;