题目内容
2. 已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3
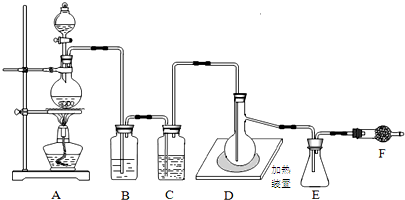
已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.实验步骤:
Ⅰ、在60mL三颈烧瓶中加入16.0mL50%硝酸(ρ=1.31g•cm-3)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b.用仪器b滴加5.3mL环己醇(ρ=0.9624g•cm-3),搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液.
Ⅱ、首先将瓶内液体加热到50℃左右,开动搅拌器,滴入环己醇,使反应处于微沸状态.滴加完毕后于90℃左右水浴加热20分钟,至反应完毕.
Ⅲ、趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重.
Ⅳ、将粗产品在水中进行重结晶操作.
请回答下列问题:
(1)仪器a的名称是冷凝管.仪器b在使用前应检查是否漏水.
(2)偏钒酸铵的作用是催化剂.
(3)反应完成后,趁热倒出反应液的目的是反应刚结束的时候,反应液容易倒出,若冷却至室温,己二酸会结晶析出,不容易倒出,造成产品的损失.
(4)本实验中己二酸的理论产量为7.4g.
(5)用纯碱液吸收尾气时发生的相关化学反应为:
2NO2+NaCO3═NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3═2NaNO2+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g.则吸收液中NaNO2和NaNO3的物质的量之比为5:3.
分析 (1)根据实验装置图及常见的仪器分析;带有玻璃塞的仪器使用前用检漏;
(2)根据反应原理可知,偏钒酸铵不参加反应,作催化剂;
(3)已二酸常温下为固体,温度较低时会从溶液中析出;
(4)加入的硝酸的质量为:16.0mL×1.31g/mL×50%=10.5g,环己醇的质量为:5.3mL×0.9624g/mL=5.1g,根据方程式判断二者哪个过量,按照量少的计算己二酸的理论产量;
(5)设NaNO2的物质的量为xmol,NaNO3的物质的量为ymol,
2NO2+Na2CO3═NaNO2+NaNO3+CO2
2y y y y
NO+NO2+Na2CO3═2NaNO2 +CO2
$\frac{x-y}{2}$ $\frac{x-y}{2}$ x-y $\frac{x-y}{2}$
已知产生22.4L(标准状况下)CO2,则x+$\frac{x-y}{2}$=$\frac{22.4L}{22.4L/mol}$
溶液增加的质量为:2y•46+$\frac{x-y}{2}$•30+$\frac{x-y}{2}$•46-(y+$\frac{x-y}{2}$)•44=44,据此计算.
解答 解:(1)由实验装置图可知,图中仪器a的名称是冷凝管;带有玻璃塞的仪器使用前用检漏,b为分液漏斗,在使用前要检查是否漏水;
故答案为:冷凝管;检查是否漏水;
(2)已知反应原理为:3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,该反应过程中偏钒酸铵不参加反应,所以作催化剂;
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,该反应过程中偏钒酸铵不参加反应,所以作催化剂;
故答案为:催化剂;
(3)反应完成后,要趁热倒出反应液,因为己二酸常温下为固体,温度较低时会从溶液中析出,反应刚结束的时候,液体温度较高,反应液容易倒出,若冷却至室温,己二酸会结晶析出,不容易倒出,造成产品的损失;
故答案为:反应刚结束的时候,反应液容易倒出,若冷却至室温,己二酸会结晶析出,不容易倒出,造成产品的损失;
(4)加入的硝酸的质量为:16.0mL×1.31g/mL×50%=10.5g,环己醇的质量为:5.3mL×0.9624g/mL=5.1g,
反应方程式为:3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O
3×100 8×63 3×146
5.1g xg mg
则x=$\frac{8×63×5.1g}{3×100}$=8.568g,则硝酸过量,
设生成的己二酸为mg,
则m=$\frac{3×146×5.1g}{3×100}$=7.446≈7.4g,
故答案为:7.4;
(5)设NaNO2的物质的量为xmol,NaNO3的物质的量为ymol,
2NO2+NaCO3═NaNO2+NaNO3+CO2
2y y y y
NO+NO2 +Na2CO3 ═2NaNO2 +CO2
$\frac{x-y}{2}$ $\frac{x-y}{2}$ x-y $\frac{x-y}{2}$
已知产生22.4L(标准状况下)CO2,则x+$\frac{x-y}{2}$=$\frac{22.4L}{22.4L/mol}$
溶液增加的质量为:2y•46+$\frac{x-y}{2}$•30+$\frac{x-y}{2}$•46-$\frac{22.4L}{22.4L/mol}$•44=44,
联立两个方程式解得:x:y=5:3,
所以吸收液中NaNO2和NaNO3的物质的量之比为5:3;
故答案为:5:3.
点评 本题以已二酸的制备为载体,考查化学实验基本操作、关系式计算等,题目难度中等,题目的计算量较大,是对学生分析能力、计算能力和综合能力的考查.

| A. | C99H200 | B. | CO | C. | NaHCO3 | D. | CH3COOCH2CH3 |
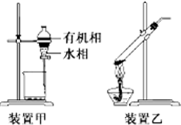
| A. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| B. | 中和滴定时,滴定管用所盛装的反应液润洗2~3次 | |
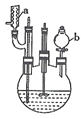
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
| A. | 氨水能导电,说明氨气是电解质 | |
| B. | 新制的氯水中存在3 种分子,4 种离子 | |
| C. | 双氧水被称为“绿色氧化剂”其还原产物为O2 | |
| D. | 王水是浓盐酸和浓硝酸按体积比1:3 配成 |
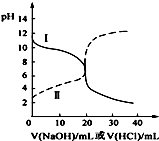 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-) |
| A. | 硫酸、硫酸镁、碳酸钠、氢氧化钠 | B. | 硝酸钾、碳酸钠、氯化钙、氯化钡 | ||
| C. | 盐酸、硫酸钠、偏铝酸钠、氢氧化钾 | D. | 硫酸、硫酸铝、氯化钠、氢氧化钠 |
 .
.
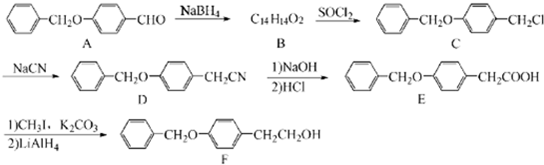
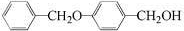 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应.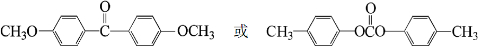 .
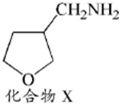
. 为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.