题目内容
14.下列有关氯元素及其化合物的表示正确的是( )| A. | 质子数为17、中子数为20的氯原子${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: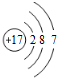 | |
| C. | 氯分子的电子式: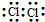 | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
分析 A、元素符号的左上角标质量数,质量数=质子数+中子数;
B、氯离子(Cl-)为Cl原子得到1个电子形成的阴离子,最外层满足8个电子的稳定结构;
C、氯气为双原子分子,最外层均满足8个电子的稳定结构;
D、氯乙烯分子中存在碳碳双键,据此解答即可.
解答 解:A、元素符号的左上角标质量数,中子数为20的氯原子,质量数=17+20=37,故正确应为:1737Cl,故A错误;
B、Cl原子得到1个电子形成最外层满足8个电子的Cl-,离子结构示意图为: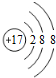 ,故B错误;
,故B错误;
C、氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构,电子式为: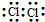 ,故C正确;
,故C正确;
D、氯乙烯分子中存在碳碳双键,正确的结构简式为:H2C=CHCl,故D错误,故选C.
点评 本题主要是对常见化学用语的考查,涉及核素的表示方法、质量数与质子数和中子数的关系、电子式的书写、结构简式书写等,难度不大.

练习册系列答案
相关题目
5.0.1mol下列气体分别与1L0.1mol•L-1的NaOH溶液反应,形成的溶液pH最小的是( )
| A. | NO2 | B. | SO2 | C. | SO3 | D. | CO2 |
19.下列实验操作正确的是( )
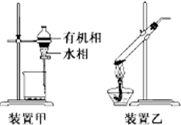

| A. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| B. | 中和滴定时,滴定管用所盛装的反应液润洗2~3次 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
15.日常生活中遇到的很多问题都涉及到化学知识,下列有关叙述正确的是( )
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 食物溶于水后的溶液 pH<7,则该食物为成酸性食物 |
 .
.

 (或
(或
 );
);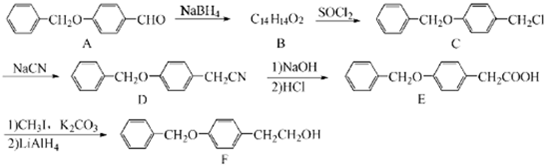
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应. .
. 为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
