题目内容
14.单质Z是一种常见的半导体材料,可由X通过如图所示的路线制备.其中X为Z的氧化物;Y为氢化物,分子结构与甲烷相似.回答下列问题: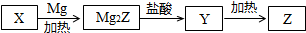
(1)能与X发生化学反应的酸是氢氟酸;由X制备Mg2Z的化学方程式为SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Mg2Si.
(2)由Mg2Z生成Y的化学方程式为Mg2Si+4HCl=2MgCl2+SiH4,Y分子的电子式为
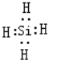 .
.(3)Z、X中共价键的类型分别是非极性键、极性键.
分析 常见的半导体材料为Si,X为Z的氧化物,那么X为二氧化硅;Y为氢化物,且分子结构与甲烷相似,那么Y为硅烷,结构简式为:SiH4,据此结合各小题解答即可.
解答 解:(1)二氧化硅为酸性氧化物,不溶于一般的酸,但是能溶于氢氟酸,此性质常用于腐蚀玻璃,由流程可知,二氧化硅与金属镁反应生成硅化镁,化学反应方程式为:SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgO↑+Mg2Si,故答案为:氢氟酸;SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Mg2Si;
(2)硅化镁与盐酸反应生成硅烷,化学反应方程式为:Mg2Si+4HCl=2MgCl2+SiH4,硅烷类似与甲烷的正四面体结构,故Si分别与H形成1对共价键,电子式为:,故答案为:Mg2Si+4HCl=2MgCl2+SiH4;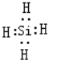 ;
;
(3)Z为Si,硅单质为原子晶体,晶体中存在Si-Si非极性共价键,X为SiO2,属于原子晶体,存在Si-O极性共价键,故答案为:非极性键、极性键.
点评 本题主要考查的是元素的推断以及硅和其化合物的知识,设计化学反应方程式书写、电子式以及共价键类型的判断,难度不大.

练习册系列答案
相关题目
4.一定温度下,可逆反应A(气)+3B(气)?2C(气)在一定容积的密闭容器中进行,达到平衡的标志是( )
| A. | 混合气体的密度不再变化 | B. | A、B、C的浓度相等 | ||
| C. | 混合气体的压强不再变化 |
5.下列有关油脂的叙述不正确的是( )
①油脂是高级脂肪酸和甘油所生成的酯
②油脂属于酯类
③油脂都能发生氢化反应
④某油脂分子中,所含烃基有三种,但每一个油脂分子中所含的三种烃基都相同,而且排列结构也相同,则该油脂为混合物
⑤天然油脂没有固定的熔点和沸点,所以天然油脂是混合物.
①油脂是高级脂肪酸和甘油所生成的酯
②油脂属于酯类
③油脂都能发生氢化反应
④某油脂分子中,所含烃基有三种,但每一个油脂分子中所含的三种烃基都相同,而且排列结构也相同,则该油脂为混合物
⑤天然油脂没有固定的熔点和沸点,所以天然油脂是混合物.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ④⑤ |
9.10mL浓度为1mol•L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )
| A. | K2SO4 | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
6.下列说法不正确的是( )
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| C. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| D. | Mg(OH)2固体在溶液存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
3.下列说法正确的是( )
| A. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
15. A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
 A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )| A. | C的氯化物与水反应,可生成白色烟雾 | |
| B. | A的氧化物对应的水化物一定为强酸 | |
| C. | D的最高价氧化物对应的水化物能和D的氢化物发生反应生成盐 | |
| D. | 向含B元素的盐溶液中滴加碳酸氢钠溶液,可能不出现白色沉淀 |
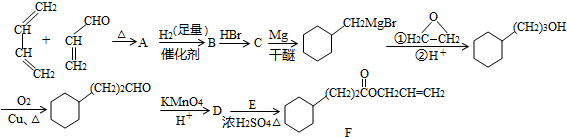
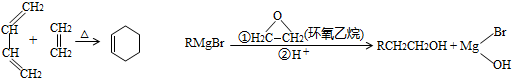
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
.  .
.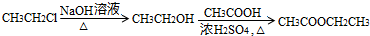

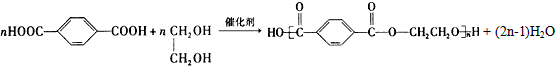 .
.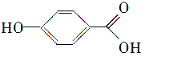 .
.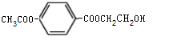 、
、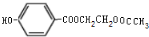 .
. .
.