题目内容
4.短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E.D既能溶于强酸,也能溶于强碱.E是一种无色、有臭鸡蛋气味的气体,E在足量空气中燃烧产生有刺激性气味的气体G,G在大气中能导致酸雨的形成.E被足量NaOH溶液吸收得到无色溶液F.溶液F在空气中长期放置发生反应,生成物之一为H.H与过氧化钠的结构和化学性质相似,其溶液显黄色.请回答下列问题:
(1)单质A是一种黄色晶体,质脆,易研成粉末.组成单质A的元素在周期表中的位置是第三周期ⅥA族,D的化学式是Al(OH)3,F中存在的化学键类型是离子键.
(2)B与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.该反应的氧化产物的化学式为Na2SO4,当生成2mol ClO2时,转移电子2mol.
(4)工业上,E常用氨水吸收,产物为酸式盐.一定条件下向该盐溶液中通入空气,得到单质A并使吸收液再生,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3.H2O+2S↓.
(5)溶液F显碱性,用离子方程式解释原因:S2-+H2O?HS-+OH-.
(6)H与过氧化钠的结构和化学性质相似,H的电子式为
 .
.
分析 短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和有臭鸡蛋气味的气体E,D既能溶于强酸,也能溶于强碱,则D为Al(OH)3,E为H2S,C为Al2S3,所以A为S,B为Al.E在足量空气中燃烧产生刺激性气味气体G,G在大气中能导致酸雨的形成,则G为SO2,E被足量氢氧化钠溶液吸收得到无色溶液F,则F为Na2S,H与过氧化钠的结构和化学性质相似,其溶液显黄色,则H为Na2S2,据此解答.
解答 解:短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和有臭鸡蛋气味的气体E,D既能溶于强酸,也能溶于强碱,则D为Al(OH)3,E为H2S,C为Al2S3,所以A为S,B为Al.E在足量空气中燃烧产生刺激性气味气体G,G在大气中能导致酸雨的形成,则G为SO2,E被足量氢氧化钠溶液吸收得到无色溶液F,则F为Na2S,H与过氧化钠的结构和化学性质相似,其溶液显黄色,则H为Na2S2.
(1)A为S,位于元素周期表中第三周期ⅥA族,D为Al(OH)3,F为Na2S,含有离子键,
故答案为:第三周期ⅥA族;Al(OH)3;离子键;
(2)B与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)SO2与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,该反应的离子方程式为:SO2+2ClO3-=SO42-+2ClO2,氧化产物为Na2SO4,SO2中S元素的化合价由+4升高为+6,则Cl元素的化合价由+5降低为+4,所以生成2mol二氧化氯时,转移电子2mol×(5-4)=2mol,
故答案为:Na2SO4;2;
(4)工业上,H2S常用氨水吸收,产物为酸式盐,则生成NH4HS,一定条件下向该盐溶液中通入空气,得到单质硫并使吸收液再生,还生成一水合氨,再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3.H2O+2S↓,
故答案为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3.H2O+2S↓;
(5)F为Na2S,溶液中S2-离子水解:S2-+H2O?HS-+OH-,破坏水的电离平衡,溶液呈碱性,
故答案为:碱;S2-+H2O?HS-+OH-;
(6)H的化学式为Na2S2,与过氧化钠的结构和化学性质相似,则其电子式为:,
故答案为: .
.
点评 本题考查无机物的推断,注意利用信息推断各物质是解答的关键,需要学生熟练掌握元素化合物性质,注意根据过氧化钠知识迁移应用,题目难度中等.

| A. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
 A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )| A. | C的氯化物与水反应,可生成白色烟雾 | |
| B. | A的氧化物对应的水化物一定为强酸 | |
| C. | D的最高价氧化物对应的水化物能和D的氢化物发生反应生成盐 | |
| D. | 向含B元素的盐溶液中滴加碳酸氢钠溶液,可能不出现白色沉淀 |
| A. |  用装置精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 | |
| B. |  装置的总反应是Cu+2Fe3+=Cu2++2Fe2+ | |
| C. |  装置中钢闸门应与外接电源的负极相连 | |
| D. |  装置中的铁钉浸入浓硫酸中几乎没被腐蚀 |
| A. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 淀粉可用于制备葡萄糖、酿制食醋,还可作药片的赋形剂 | |
| D. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
| A. | 元素的离子半径A<B<C<E | |
| B. | 工业上利用电解C的氯化物溶液的方法制备单质C | |
| C. | D的气态氢化物和最高价氧化物的水化物可能发生氧化还原反应 | |
| D. | D与C,A与D形成的化合物中化学键类型相同 |
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 为了防止容量瓶漏液,可在玻璃塞上涂上凡士林 | |
| C. | 为了使制取氢气的速率加快,可向稀硫酸中加入少量硫酸铜溶液 | |
| D. | 为了使配制的FeCl3溶液不产生混浊,可加入盐酸和铁片 |
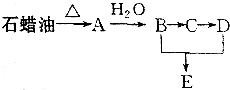 某课外小组以石蜡为原料进行如图所示转化关系的实验探究,其中E具有果香味,且分子中含4个碳原子.试填空:
某课外小组以石蜡为原料进行如图所示转化关系的实验探究,其中E具有果香味,且分子中含4个碳原子.试填空: CH3COOCH2CH3+H2O,反应类型为酯化反应.
CH3COOCH2CH3+H2O,反应类型为酯化反应.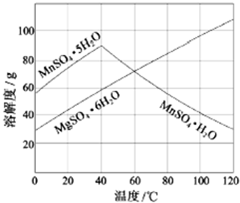 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4