题目内容
3. 直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )| A. | 电子经外电路自b极流向a极 | |
| B. | b极的电极半反应为O2+4e-+4H+=2H2O | |
| C. | 质子交换膜中的H+流向a极 | |
| D. | 以此电池供电,电解CuSO4溶液,理论上每生成0.1molCu最少需要氧气1.12L |
分析 交换膜为质子交换膜,所以电解质溶液呈酸性,燃料电池中负极上加入燃料、正极上通入氧化剂,所以该燃料电池中,a为负极、b为正极,负极反应式为CH3OH(l)+H2O(l)-6e-=CO2(g)↑+6H+、正极反应式为O2+4e-+4H+=2H2O,阳离子向正极移动,结合转移电子守恒进行计算.
解答 解:A.燃料电池中加入燃料电极是负极、加入氧化剂电极是正极,所以加入甲醇的电极a是负极、加入空气的电极b是正极,电子从 a沿导线流向b电极,故A错误;
B.b是正极,电解质溶液呈酸性,正极反应式为O2+4e-+4H+=2H2O,故B正确;
C.放电时,阳离子向正极移动,a是负极、b是正极,所以质子交换膜中的H+流向b极,故C错误;
D.温度和压强未知,无法确定气体摩尔体积,所以不能计算需要氧气体积,故D错误;
故选B.
点评 本题考查化学电源新型电池,明确原电池原理是解本题关键,为高频考点,知道正负极的判断、电极反应式的书写、离子及电子移动方向,易错选项是D,题目难度中等.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
11.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域.一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如图1:

已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表所示;
②不同离子沉淀的pH如图2所示.
(1)步骤Ⅰ中进行原料预处理的目的为除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量.
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤Ⅴ中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-25)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.

已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表所示;
②不同离子沉淀的pH如图2所示.
| 阶段/含量%/成分 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤Ⅴ中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-25)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
18.已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
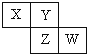

| A. | Z单质的化学活泼性一定比Y单质的强 | |
| B. | W的原子序数可能是Y的原子序数的2倍 | |
| C. | W的气态氢化物的稳定性一定比Y的强 | |
| D. | X和W两元素不可能形成共价化合物 |
8.如图有关图示分析正确的是( )
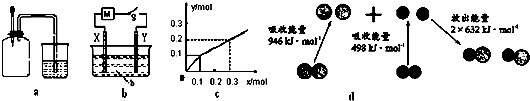

| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| C. | 如图b所示,X为铁棒,Y为铜棒,M为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入M | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,其热化学方程式为 N2(g)+O2(g)═2NO(g)△H=-180 kJ/mol |
15. A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
 A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )
A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,已知这四种元素中只有一种是金属元素.下列判断正确的是( )| A. | C的氯化物与水反应,可生成白色烟雾 | |
| B. | A的氧化物对应的水化物一定为强酸 | |
| C. | D的最高价氧化物对应的水化物能和D的氢化物发生反应生成盐 | |
| D. | 向含B元素的盐溶液中滴加碳酸氢钠溶液,可能不出现白色沉淀 |
12.关于下列各装置图的叙述不正确的是( )
| A. |  用装置精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 | |
| B. |  装置的总反应是Cu+2Fe3+=Cu2++2Fe2+ | |
| C. |  装置中钢闸门应与外接电源的负极相连 | |
| D. |  装置中的铁钉浸入浓硫酸中几乎没被腐蚀 |
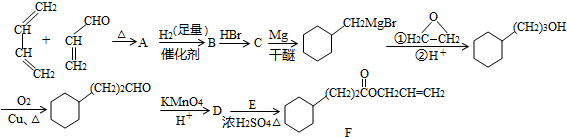
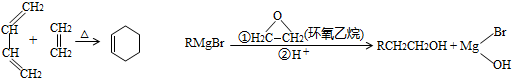
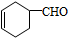 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键.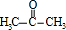 .
.  .
.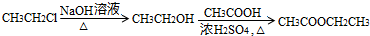
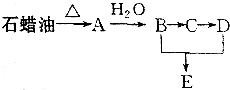 某课外小组以石蜡为原料进行如图所示转化关系的实验探究,其中E具有果香味,且分子中含4个碳原子.试填空:
某课外小组以石蜡为原料进行如图所示转化关系的实验探究,其中E具有果香味,且分子中含4个碳原子.试填空: CH3COOCH2CH3+H2O,反应类型为酯化反应.
CH3COOCH2CH3+H2O,反应类型为酯化反应.