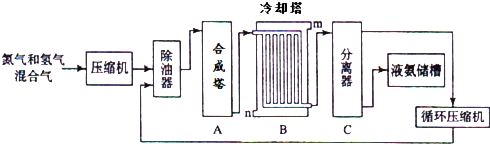
题目内容
14. 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性.实验如下:
Ⅰ.用pH试纸检验,漂白液pH>7,饱和KAl(SO4)2溶液pH<7.
Ⅱ.取10mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸.
Ⅲ.另取10mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色.
Ⅳ.再取10mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色.
①漂白液pH大于7的原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
②由实验Ⅱ得出ClO-具有氧化性,写出反应的离子方程式Ba2++ClO-+SO32-=BaSO4↓+Cl-.
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是ClO-的氧化性随氢离子浓度增大而增大.
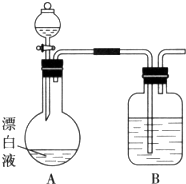
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成.用如图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2.
①装置B的作用是吸收氯气防止污染空气.
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生.A中反应的离子方程式ClO-+Cl-+2H+=Cl2↑+H2O.
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生.A中加KAl(SO4)2溶液反应的离子方程式是3ClO-+Al3++3H2O=3HClO+Al(OH)3↓.
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2.若取10mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是生成白色沉淀.
分析 (1)①NaClO为强碱弱酸盐,水解显碱性;
②Ⅱ中由白色沉淀生成,经检验白色沉淀不溶于盐酸,可知白色沉淀为BaSO4,发生氧化还原反应;
Ⅳ中加入少量稀硫酸酸化后,溶液红色立即变为无色,生成HClO,氧化性增强;
(2)①漂白液在酸性溶液中有Cl2生成,则分液漏斗中为酸,B中盛放NaOH溶液吸收氯气,以此来解答;
②次氯酸钙和氯化钙加入硫酸发生氧化还原反应生成氯气硫酸钙和水;
③烧瓶中加入饱和KAl(SO4)2溶液,次氯酸根离子水解显碱性,铝离子水解显酸性,混合后水解相互促进,产生大量的白色胶状沉淀和次氯酸;
(3)过量的SO2气体通入漂白液中,次氯酸具有氧化性氧化二氧化硫为硫酸,发生氧化还原反应,结合钡离子生成硫酸钡白色沉淀.
解答 解:(1)①NaClO为强碱弱酸盐,水解显碱性,水解离子反应为ClO-+H2O?HClO+OH-,故答案为:ClO-+H2O?HClO+OH-;
②Ⅱ中由白色沉淀生成,经检验白色沉淀不溶于盐酸,可知白色沉淀为BaSO4,发生氧化还原反应,反应的离子方程式为:Ba2++ClO-+SO32-=BaSO4↓+Cl-;,
故答案为:Ba2++ClO-+SO32-=BaSO4↓+Cl-;
③Ⅳ中加入少量稀硫酸酸化后,溶液红色立即变为无色,生成HClO,氧化性增强,
由上述两个实验对比可知,加入酸,反应速率加快,则ClO-的氧化性随氢离子浓度增大而增大,
故答案为:ClO-的氧化性随氢离子浓度增大而增大;
(2)①漂白液在酸性溶液中有Cl2生成,则分液漏斗中为酸,B中盛放NaOH溶液,其作用为吸收氯气、防止污染空气,
故答案为:吸收氯气防止污染空气;
②次氯酸钙和氯化钙加入硫酸发生氧化还原反应生成氯气硫酸钙和水,反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
③烧瓶中加入饱和KAl(SO4)2溶液,次氯酸根离子水解显碱性,铝离子水解显酸性,混合后水解相互促进,产生大量的白色胶状沉淀和次氯酸,反应的离子方程式为:
3ClO-+Al3++3H2O=3HClO+Al(OH)3↓,将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生为氯气,充分反应后集气瓶中收集到一种无色无味的气体为氧气.依据氧化还原反应电子守恒写出化学方程式配平得到:4HClO$\frac{\underline{\;光照\;}}{\;}$2H2O+2Cl2↑+O2↑,
故答案为:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;
(3)过量的SO2气体通入漂白液中,次氯酸具有氧化性氧化二氧化硫为硫酸,发生氧化还原反应,结合钡离子生成硫酸钡白色沉淀,
故答案为:生成白色沉淀.
点评 本题考查了次氯酸盐的性质分析判断,主要是氧化性和产物分析,离子方程式书写方法,掌握基础是解题关键,题目难度中等.

| A. | 标准状况下,22.4L H2含有的原子数为NA | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 常温常压下,14g N2含有电子数为7NA | |
| D. | 等质量的CO与CO2中所含碳原子数之比为7﹕11 |
| A. | 活泼的金属粉尘遇明火均易引起爆炸 | |
| B. | 任何金属粉末在不正确操作下均可能引起爆炸 | |
| C. | 汽车轮毂表面镀铝既增加美观度,又耐腐蚀 | |
| D. | 事故告诫人们安全生产,防污、防爆非常重要 |
| A. | Cu2S在反应中既是氧化剂又是还原剂 | |
| B. | 以上反应中转移电子的物质的量为1 mol | |
| C. | 以上参加反应的HNO3中被还原的HNO3为2 mol | |
| D. | 反应中,氧化剂和还原剂的物质的量之比为4:3 |

下列说法错误的是( )
| A. | 滤液A中不含Fe3+ | |
| B. | 样品中含氧元素的物质的量为0.01mol | |
| C. | 上图中V=112 | |
| D. | 溶解样品的过程中消耗的硫酸的总的物质的量为0.02mol |
| A. | 升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大 | |
| B. | 增大反应物浓度,单位体积内活化分子数增多,有效碰撞的几率增大,反应速率增大 | |
| C. | 具有足够能量的分子相互碰撞就一定能发生化学反应 | |
| D. | 正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大 |
| A. | 负极:4OH--4e-═O2+2H2O | B. | 负极:H2+2OH--2e-═2H2O | ||
| C. | 正极:O2+4e-═4O2- | D. | 正极:H2-2e-═2H+ |
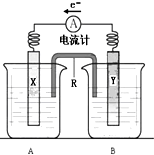 如图是铜锌原电池装置.其电池的总反应是:
如图是铜锌原电池装置.其电池的总反应是: