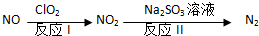题目内容
1.氢氧燃料电池以H2为还原剂,O2为氧化剂,电极为多孔镍,电解液为30%的KOH溶液,下列电极反应式正确的是( )| A. | 负极:4OH--4e-═O2+2H2O | B. | 负极:H2+2OH--2e-═2H2O | ||
| C. | 正极:O2+4e-═4O2- | D. | 正极:H2-2e-═2H+ |
分析 该原电池中电解质溶液呈碱性,负极上氢气失电子和氢氧根离子反应生成水;正极上氧气得电子发生还原反应生成氢氧根离子,据此分析判断.
解答 解:A.该原电池中电解质溶液呈碱性,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为2H2-2e-+2OH-=2H2O,故A错误;
B.该原电池中电解质溶液呈碱性,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为2H2-2e-+2OH-=2H2O,故B正确;
C.正极上氧气得电子发生还原反应生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-,故C错误;
D.正极上氧气得电子发生还原反应生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-,故D错误;
故选B.
点评 本题考查化学电源新型电池,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,注意:碱性条件下电极反应式中不能生成氢离子.

练习册系列答案
相关题目
13.常温,下列各组离子,在指定的环境中一定能大量共存的是( )
| A. | 含大量Al3+的溶液中:Na+、AlO2-、SO42-、I- | |
| B. | 在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32- | |
| C. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、AlO2-、S2-、CO32- | |
| D. | c(H+)=10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
9.下列有关叙述中,不正确的是( )
| A. | 水能微弱的电离,是电解质 | B. | 单质铜能导电,但不是电解质 | ||
| C. | 硫酸钡难溶于水,但是电解质 | D. | 氯化氢是气体,所以不是电解质 |
16.在pH=1的无色透明溶液中能存在的离子组是( )
| A. | AlO2-、Ba2+、NO3-、Na+ | B. | H+、Cl-、Na+、SO42- | ||
| C. | Na+、Cu2+、CO32-、K+ | D. | H+、Fe2+、Mg2+、NO3- |
6.要除去下列各物质里的少量杂质(括号内为杂质),请按要求写出所用试剂的化学式,并在下面操作方法中选择恰当方法的编号填入表中.可供选择的操作方法:①过滤 ②洗气 ③分液 ④蒸发 ⑤蒸馏
| NO(NO2) | NH4Cl(AlCl3) | FeCl2(FeCl3) | NaNO3(NH4NO3) | |
| 所选试剂化学式 | ||||
| 操作方法编号 |
13.下列反应属于取代反应的是( )
| A. | 由乙烯制乙烷 | B. | 由甲烷制四氯化碳 | ||
| C. | 乙烷在氧气中燃烧 | D. | 由乙醇制乙烯 |
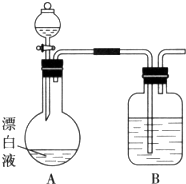 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.