题目内容
10.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:
下列说法错误的是( )
| A. | 滤液A中不含Fe3+ | |
| B. | 样品中含氧元素的物质的量为0.01mol | |
| C. | 上图中V=112 | |
| D. | 溶解样品的过程中消耗的硫酸的总的物质的量为0.02mol |
分析 硫酸足量,氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣1.6g为金属铜,物质的量为0.025mol,即合金样品中总共含有铜元素0.025mol;
滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体1.6g为Fe2O3,物质的量为0.01mol,铁元素的物质的量为0.02mol,滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol;
硫酸中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧元素的质量,进而计算合金中氧原子的物质的量,计算氧原子结合氢离子物质的量,再根据H原子守恒生成氢气的体积.
解答 解:A.与硫酸反应后有滤渣,一定含Cu、则滤液A中一定不含Fe3+,故A正确;
B.滤渣1.6g为金属铜,物质的量为0.025mol,即合金样品中总共含有铜元素0.025mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体1.6g为Fe2O3,物质的量为0.01mol,铁元素的物质的量为0.02mol,合金中Fe元素质量=0.02mol×56g/mol=1.12g,Cu元素质量为1.6g,故合金中氧原子的物质的量$\frac{2.88g-1.12g-1.6g}{16g/mol}$=0.01mol,故B正确;
C.只有Fe与硫酸反应生成氢气,由Fe+H2SO4=FeSO4+H2↑、Fe+Fe2O3+3H2SO4=3FeSO4+3H2O可知,参加反应硫酸物质的量为0.02mol,硫酸含氢离子0.04mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,它结合氢离子0.02mol,所以硫酸中有0.04mol-0.02mol=0.02mol H+生成氢气,即生成0.01mol氢气,标况体积=0.01mol×22.4L/mol=0.224L=224mL,故C错误;
D.滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.02mol,说明参加反应硫酸物质的量为0.02mol,故D正确;
故选C.
点评 本题考查物质含量的测定,为高频考点,把握发生的反应、固体与滤液的成分等为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

 小题狂做系列答案
小题狂做系列答案| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | NaOH溶液与醋酸反应:H++OH-═H2O | |
| C. | 稀H2SO4与纯碱溶液反应:2H++Na2CO3═2Na++CO2↑+H2O | |
| D. | 少量二氧化碳与氢氧化钾反应:CO2+2OH-═CO32-+H2O |
| A. | 碱性氧化物一定是金属氧化物,但酸性氧化物不一定都是非金属氧化物 | |
| B. | 胶体会产生电泳现象是因为胶体吸附带电离子而显电性 | |
| C. | 电解质与非电解质的本质区别是水溶液能否导电 | |
| D. | 离子反应是否能够发生要看离子之间能否发生复分解反应 |
| U | ||
| Y |
(2)YO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VO,有关反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+.由此可知YO2和VO还原性较强的是(写化学式)SO2.
(3)V的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境.其化学方程式为2NH3+3H2O2=N2+6H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下 表中反应条件x,该平衡体系中随x递增y递增的是bc(填代号).
| 选 项 | a | b | C | d |
| X | 温度 | 温度 | 加入H2的 物质的量 | 加入甲的 物质的量 |
| V | 混合气体总质量与混合合气 体总物质的量之比 | 平衡常数 K | 混合气体的 密度 | 平衡时甲的 转化率 |
当加入的Fe粉质量为70g时.溶液中n(Fe3+):n(Fe2+)=2:3.
(4)相同温度下,等体积、物质的量浓度为0.1mol/L的KZ和CH3COOK溶液的两种
溶液中,离子总数相比较A(填代号)
A.前者多 B.-样多C.后者多 D.无法判断.
| A. | 食物储存在冰箱里 | |
| B. | 用MnO2作H2O2分解反应的催化剂 | |
| C. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| D. | 用1 mol/L H2SO4溶液代替3 mol/L H2SO4溶液与锌粒反应 |
| A. | AlO2-、Ba2+、NO3-、Na+ | B. | H+、Cl-、Na+、SO42- | ||
| C. | Na+、Cu2+、CO32-、K+ | D. | H+、Fe2+、Mg2+、NO3- |
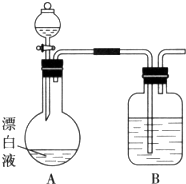 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.