题目内容
【题目】在试管A中先加入46 g CH3CH2OH,边摇动边缓缓加入2 mL浓硫酸并充分摇匀,冷却后再加入30 g CH3COOH,充分混合后将试管固定在铁架台上,在试管B中加入7mL C溶液。连接好装置用酒精灯对试管A加热,当观察到试管B中有明显现象时停止加热。
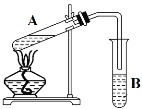
(1)浓硫酸的作用是__________
(2)B装置中观察到的现象是______
(3)溶液C为_________, B中导管未插入液面以下,其原因是__________
A 饱和NaOH溶液 b 水 c 饱和Na2CO3溶液d CCl4
(4)最后通过分离提纯得到乙酸乙酯 30.8 g ,则乙酸乙酯的实际产率是____(实际产率 = ![]() ×100%)
×100%)
【答案】催化剂 吸水剂 溶液分层,液面上有无色透明的不溶于水的油状液体产生 c 防止倒吸 70%
【解析】
该实验装置是实验室制取乙酸乙酯的实验装置,反应为CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O,实验中,为防止浓硫酸加入水中放热,造成液体飞溅引发实验安全,药品的添加顺序为:在试管A中先加入46 g CH3CH2OH,边摇动边缓缓加入2 mL浓硫酸并充分摇匀,冷却后再加入30 g CH3COOH,充分混合后将试管固定在铁架台上,加热制取乙酸乙酯,一段时间后在B试管液面上产生无色透明油状液体,即为乙酸乙酯,据此分析解答。
CH3COOC2H5+H2O,实验中,为防止浓硫酸加入水中放热,造成液体飞溅引发实验安全,药品的添加顺序为:在试管A中先加入46 g CH3CH2OH,边摇动边缓缓加入2 mL浓硫酸并充分摇匀,冷却后再加入30 g CH3COOH,充分混合后将试管固定在铁架台上,加热制取乙酸乙酯,一段时间后在B试管液面上产生无色透明油状液体,即为乙酸乙酯,据此分析解答。
(1)浓硫酸在制取乙酸乙酯的实验中的催化剂和吸水剂;
(2)生成的乙酸乙酯在水溶液上层,试管中观察到的现象是:溶液分层,液面上有无色透明的不溶于水的油状液体产生;
(3)实验中使用的乙酸和乙醇都具有挥发性,加热条件可加速二者挥发,则制得的乙酸乙酯中混有乙酸和乙醇,应使用饱和碳酸钠溶液,既可以除去乙酸,还能溶解乙醇;为防止乙酸和乙醇两种蒸气被吸收而引起倒吸现象,B装置中的导管不能插入液面以下;
(4)46 g CH3CH2OH的物质的量为![]() =1mol,30 g CH3COOH的物质的量为
=1mol,30 g CH3COOH的物质的量为![]() =0.5mol,制取乙酸乙酯的反应为CH3COOH+CH3CH2OH
=0.5mol,制取乙酸乙酯的反应为CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O,则乙醇过量,用乙酸的量计算,理论上乙酸完全参与反应生成乙酸乙酯的物质的量为0.5mol,则质量为0.5mol×88g/mol=44g,最后通过分离提纯得到乙酸乙酯 30.8 g ,则乙酸乙酯的实际产率是=
CH3COOC2H5+H2O,则乙醇过量,用乙酸的量计算,理论上乙酸完全参与反应生成乙酸乙酯的物质的量为0.5mol,则质量为0.5mol×88g/mol=44g,最后通过分离提纯得到乙酸乙酯 30.8 g ,则乙酸乙酯的实际产率是= ![]() ×100%=
×100%=![]() ×100%=70%。
×100%=70%。

 阅读快车系列答案
阅读快车系列答案【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
________ | ________ | ________ | ________ |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为________.
(3)碳酸:H2CO3 , K1=4.3×10﹣7 , K2=5.6×10﹣11 草酸:H2C2O4 , K1=5.9×10﹣2 , K2=6.4×10﹣5 ,0.1mol/LNa2CO3溶液的pH____0.1mol/LNa2C2O4溶液的pH,(选填“大于”“小于”或“等于”),等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___.
(4)在如图的转化关系中(X代表卤素)。ΔH2_____0(填“>”、“=”或“<”);△H1、△H2和△H3三者存在的关系为_______。

(5)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题:
①醋酸钠中各离子浓度由大到小的顺序是_______。
②醋酸和醋酸钠等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=______mol·L-1。