题目内容
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
________ | ________ | ________ | ________ |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为________.
(3)碳酸:H2CO3 , K1=4.3×10﹣7 , K2=5.6×10﹣11 草酸:H2C2O4 , K1=5.9×10﹣2 , K2=6.4×10﹣5 ,0.1mol/LNa2CO3溶液的pH____0.1mol/LNa2C2O4溶液的pH,(选填“大于”“小于”或“等于”),等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___.
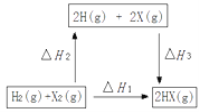
(4)在如图的转化关系中(X代表卤素)。ΔH2_____0(填“>”、“=”或“<”);△H1、△H2和△H3三者存在的关系为_______。
(5)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题:
①醋酸钠中各离子浓度由大到小的顺序是_______。
②醋酸和醋酸钠等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=______mol·L-1。
【答案】增大 增大 减小 减小 cd2/ab4=xy3/mn4 大于 草酸 > △H1 =△H2+△H3 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 0.1
【解析】
(1)温度从300℃升至400℃,升高温度,化学反应速率增大,即正逆反应速率都增大,v正增大,v逆增大,根据题意,已知H2的体积分数随温度的升高而增加,说明升高温度,平衡向逆反应方向进行,即该反应的正反应为放热反应,化学平衡常数只受温度的影响,即升高温度,化学平衡常数减小,转化率降低;
(2)同一反应,温度相同,化学平衡常数不变,平衡I中化学平衡常数的表达式为K=![]() ,同理平衡Ⅱ中K=
,同理平衡Ⅱ中K=![]() ,即cd2/ab4=xy3/mn4;
,即cd2/ab4=xy3/mn4;
(3)碳酸的二级电离常数为Ka2=5.6×10-11,草酸的二级电离平衡常数Ka2=6.4×10-5,依据越弱越水解,推出CO32-水解程度大于C2O42-,即相同浓度时,Na2CO3水溶液的pH大于Na2C2O4水溶液的pH,电离平衡常数越大,说明电离程度越强,对酸来说,电离平衡常数越大,酸性越强,即草酸电离出c(H+)大;
(4)H2和X2转化成2H和2X,发生断键,断键吸收能量,即△H2>0,反应热只与始态和终态有关,与反应过程无关,即△H1=△H2+△H3;
(5)①醋酸钠属于强碱弱酸盐,溶液显碱性,CH3COO-发生水解,但CH3COO-水解微弱,离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
②根据物料守恒,令CH3COOH和醋酸钠的体积各为1L,c(CH3COOH)+c(CH3COO-)=(1L×0.1mol·L-1+1L×0.1mol·L-1)/(1L+1L)=0.1mol·L-1。

【题目】元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是_______(填元素符号,下同)、非金属性最强的是______,用电子式表示上述两种元素形成化合物的过程___________。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_______________,其氢化物的电子式是___________________________。
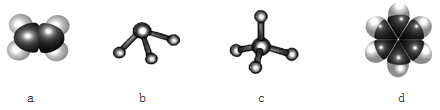
(3)元素①和③可以形成多种化合物。下图模型表示的分子中,可能由①和③形成的是_____________________________________________________(请用结构简式作答)。
(4)元素③、⑤的最高价氧化物对应水化物中酸性较强的是_________(填化学式),说明你判断的理由:____________________________________________________。
(5)主族元素砷(As)的部分信息如图所示。
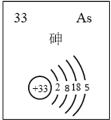
①砷(As)在周期表中的位置是________________。
②下列说法正确的是_______(填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.⑥的气态氢化物的还原性大于砷的气态氢化物的还原性
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
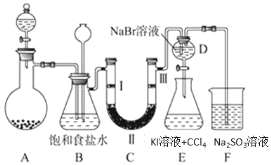
(1)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放______
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量的氯气时,可以看到无色溶液逐渐变为橙黄色,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是下层溶液呈紫色,则证明了溴单质的氧化性强于碘单质,但是有同学对该结论提出异议,可能理由是___________。
(3)烧杯F中的 亚硫酸钠溶液用来吸收尾气,设计实验方案验证尾气吸收后溶液中含有 SO42-_____。