题目内容
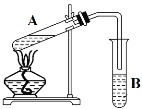
【题目】某同学欲证明乙炔能与KMnO4酸性溶液反应,实验方案如下:将电石与水反应生成的气体通入KMnO4酸性溶液,溶液褪色,证明二者发生了反应。请回答:
(1)制备乙炔的反应的化学方程式是_______。
(2)该同学的实验方案存在的问题是______。
(3)为了解决上述问题,需重新选择实验装置,备选装置如图所示。

①将装置编号按顺序填在横线上___→B→__________。
②B装置中所盛放的试剂是____________。
(4)乙炔使酸性KMnO4溶液褪色的离子方程式是_____。
【答案】CaC2+2H2O→Ca(OH)2+HC≡CH↑ 电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂 C D 硫酸铜溶液 C2H2+2MnO4﹣+6H+═2CO2+2Mn2++4H2O
【解析】
根据乙炔的性质书写乙炔制备及相关反应方程式;根据实验目的分析实验中装置的作用及所用的试剂。
(1)碳化钙与水反应生成氢氧化钙和乙炔,该反应为CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(2)该同学的实验方案存在的问题是电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂,故答案为:电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂;
(3)①固体与液体反应制备乙炔,选择装置C,再利用B装置除杂,最后利用D装置检验乙炔,故答案为:C;D;
②B装置除去硫化氢,则所盛放的试剂是硫酸铜溶液;
(4)乙炔使酸性KMnO4溶液褪色是因为被高锰酸钾氧化生成二氧化碳,反应的离子方程式是C2H2+2MnO4﹣+6H+═2CO2+2Mn2++4H2O。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是_______(填元素符号,下同)、非金属性最强的是______,用电子式表示上述两种元素形成化合物的过程___________。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_______________,其氢化物的电子式是___________________________。
(3)元素①和③可以形成多种化合物。下图模型表示的分子中,可能由①和③形成的是_____________________________________________________(请用结构简式作答)。

(4)元素③、⑤的最高价氧化物对应水化物中酸性较强的是_________(填化学式),说明你判断的理由:____________________________________________________。
(5)主族元素砷(As)的部分信息如图所示。

①砷(As)在周期表中的位置是________________。
②下列说法正确的是_______(填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.⑥的气态氢化物的还原性大于砷的气态氢化物的还原性