题目内容
【题目】按要求填空:
(1)写出下列物质的电子式:Na2O2_____NH3_____。
(2)2.2g铵根14N2H4+的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有 18个电子,该粒子的化学符号是____。
(3)已知断开 1mol H—H 键、1mol I—I 键、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ,则由 1mol H2和 1mol I2生成 2mol HI会_____(“放出”或“吸收”)_____kJ 的热量。
(4)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S,只由离子键构成的物质是_____(填序号,同下),由离子键和共价键构成的物质是_________,属于共价化合物的是_____。
【答案】![]()
![]() 1.1NA NA
1.1NA NA ![]() 放出 11 ⑤ ②③⑥ ④⑦
放出 11 ⑤ ②③⑥ ④⑦
【解析】
(1)Na2O2是离子化合物,其电子式为![]() ;NH3是共价化合物,其电子式为
;NH3是共价化合物,其电子式为![]() ;
;
(2)1个14N2H4+铵根离子中有7+4×1=11个中子,7+4×1-1=10个电子,其摩尔质量为14+4×2=22g/mol,2.2g该铵根为0.1mol,故0.1mol14N2H4+中有11×0.1=1.1mol中子,为1.1NA个;有10×0.1=1mol电子,为NA个;核中有17个质子,20个中子,核外有18个电子,则该元素为Cl元素,质量数为17+20=37;离子符号为![]() ;
;
(3)H2与I2反应生成HI的化学方程式为H2+I2![]() 2HI,该反应的反应热可以通过反应物的键能总和减去生成物的键能总和计算,当计算值为正值时为吸热反应,计算值为负值时为放热反应,该反应的反应热为436kJ+151kJ-2×299kJ=-11kJ,故该反应为放热反应,共放出11kJ能量;
2HI,该反应的反应热可以通过反应物的键能总和减去生成物的键能总和计算,当计算值为正值时为吸热反应,计算值为负值时为放热反应,该反应的反应热为436kJ+151kJ-2×299kJ=-11kJ,故该反应为放热反应,共放出11kJ能量;
(4)①H2是由极性共价键构成的单质;
②Na2O2是有离子键和非极性共价键构成的离子化合物;
③NaOH是由离子键和极性共价键构成的离子化合物;
④H2O2是由极性共价键和非极性共价键构成的共价化合物;
⑤CaCl2是由离子键构成的离子化合物;
⑥NH4NO3是由离子键和极性共价键构成的离子化合物;
⑦H2S是由极性共价键构成的共价化合物;
只由离子键构成的物质是⑤,由离子键和共价键构成的物质是②③⑥,属于共价化合物的是④⑦。

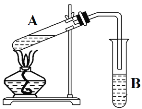
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
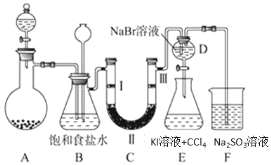
(1)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放______
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量的氯气时,可以看到无色溶液逐渐变为橙黄色,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是下层溶液呈紫色,则证明了溴单质的氧化性强于碘单质,但是有同学对该结论提出异议,可能理由是___________。
(3)烧杯F中的 亚硫酸钠溶液用来吸收尾气,设计实验方案验证尾气吸收后溶液中含有 SO42-_____。
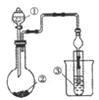
【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D