题目内容
【题目】六苯乙烷为无色晶体,其结构如图所示。下列有关说法中正确的是( )
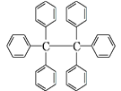
A. 它是一种苯的同系物,易溶于有机溶剂中
B. 它的分子式为C38H30,只含有非极性键
C. 它的分子中所有原子共平面
D. 核磁共振氢谱有3组峰
【答案】D
【解析】
A. 苯的同系物只能含有一个苯环,该物质中有6个苯环,所以不是苯的同系物,故A错误;
B. 根据结构简式知它的分子式为C38H30,苯环上的碳原子与氢原子之间的共价键具有极性,属于极性键,故B错误;
C. 从乙烷的结构可以分析知,乙烷中所有原子不可能在一个平面上,所以六苯乙烷的分子中所有原子不可能共平面,故C错误;
D. 根据结构的对称性,6个苯环化学环境一样,其中每个苯环上的氢原子有邻、间、对三种,,所以该有机物核磁共振氢谱有3组峰,故D正确;
故选D。

【题目】元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是_______(填元素符号,下同)、非金属性最强的是______,用电子式表示上述两种元素形成化合物的过程___________。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_______________,其氢化物的电子式是___________________________。
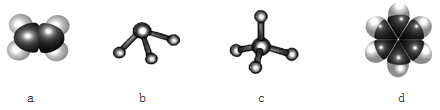
(3)元素①和③可以形成多种化合物。下图模型表示的分子中,可能由①和③形成的是_____________________________________________________(请用结构简式作答)。
(4)元素③、⑤的最高价氧化物对应水化物中酸性较强的是_________(填化学式),说明你判断的理由:____________________________________________________。
(5)主族元素砷(As)的部分信息如图所示。
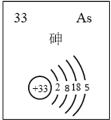
①砷(As)在周期表中的位置是________________。
②下列说法正确的是_______(填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.⑥的气态氢化物的还原性大于砷的气态氢化物的还原性
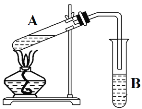
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
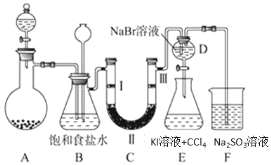
(1)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放______
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量的氯气时,可以看到无色溶液逐渐变为橙黄色,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是下层溶液呈紫色,则证明了溴单质的氧化性强于碘单质,但是有同学对该结论提出异议,可能理由是___________。
(3)烧杯F中的 亚硫酸钠溶液用来吸收尾气,设计实验方案验证尾气吸收后溶液中含有 SO42-_____。