题目内容
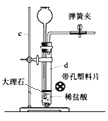
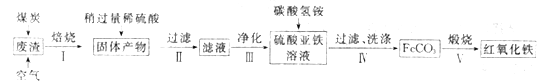
【题目】如图是实验室制取氯气并以氯气为原料进行特定反应的装置。其中:A中盛有MnO2,B中盛有浓盐酸。

(1)用下列两种方法制取氯气:
①用含HCl146g的浓盐酸与足量的MnO2反应;
②用87gMnO2与足量的浓盐酸反应。不考虑HCl的挥发,
则两种方法生成的氯气的量是方法①___②(填“>”、“<”或“=”)。
(2)仪器B的名称是__。
(3)C中盛饱和食盐水(氯气在其中的溶解度很小),是为了除去氯气中混有的__气体。
(4)仪器D用来干燥氯气,其中盛放的试剂是__。
(5)E中装铁粉,其中发生反应的化学方程式是__。
(6)G中盛有NaOH溶液,目的是___。其中发生反应的离子方程式是___。
【答案】< 分液漏斗 HCl 浓硫酸 2Fe+3Cl2=FeCl3 吸收Cl2 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)MnO2与热的浓盐酸发生反应,生成二氯化锰和氯气,反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;当盐酸浓度减小到一定程度时,与MnO2就不能再发生反应。
MnCl2+Cl2↑+2H2O;当盐酸浓度减小到一定程度时,与MnO2就不能再发生反应。
①含HCl146g的浓盐酸与足量的MnO2反应,此时HCl为4mol,生成Cl2小于1mol;
②87gMnO2为1mol,与足量的浓盐酸反应,可生成Cl21mol;
通过前面的计算便可确定两种方法生成氯气的量的大小关系。
(2)仪器B的名称是分液漏斗;
(3)C中盛饱和食盐水(氯气在其中的溶解度很小),是为了除去氯气中混有的HCl气体;
(4)仪器D用来干燥氯气,其中盛放的试剂是液体干燥剂,只能为浓硫酸;
(5)E中装铁粉,发生铁与氯气生成三氯化铁的反应;
(6)G中盛有NaOH溶液,目的是吸收氯气,防止污染环境。
(1)MnO2与热的浓盐酸发生反应,生成二氯化锰和氯气,反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;当盐酸浓度减小到一定程度时,与MnO2就不能再发生反应。
MnCl2+Cl2↑+2H2O;当盐酸浓度减小到一定程度时,与MnO2就不能再发生反应。
①含HCl146g的浓盐酸与足量的MnO2反应,此时HCl为4mol,生成Cl2小于1mol;
②87gMnO2为1mol,与足量的浓盐酸反应,可生成Cl21mol;
则两种方法生成的氯气的量是方法①<②;答案为:<;
(2)仪器B的名称是分液漏斗;答案为:分液漏斗;
(3)C中盛饱和食盐水,因为氯气微溶于饱和食盐水,而氯化氢易溶于饱和食盐水,所以是为了除去氯气中混有的HCl气体;答案为:HCl;
(4)仪器D用来干燥氯气,其中盛放的试剂是液体干燥剂,只能为浓硫酸;答案为:浓硫酸;
(5)E中装铁粉,发生铁与氯气生成三氯化铁的反应,方程式为3Cl2 +2Fe![]() 2FeCl3;
2FeCl3;
答案为:3Cl2 +2Fe![]() 2FeCl3;
2FeCl3;
(6)G中盛有NaOH溶液,目的是吸收氯气,防止污染环境;发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;答案为:吸收Cl2;Cl2+2OH-=Cl-+ClO-+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D