题目内容
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
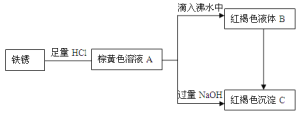
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
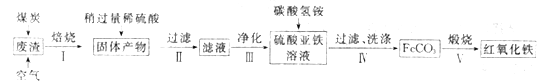
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:
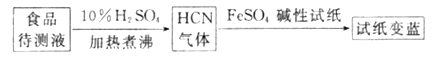
若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
【答案】c CO、SO2等 5 Fe2++2HCO3=FeCO3↓+2CO2↑+H2O Fe(OH)3 Fe3++3H2OFe(OH)3↓+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀; 3[Fe(CN)6]4+4Fe3+=Fe4[Fe(CN)6]3↓ 碱性条件下,Fe2+与CN结合生成[Fe(CN)6]4,Fe2+被空气中O2氧化生成Fe3+,[Fe(CN)6]4与Fe3+反应生成普鲁士蓝使试纸显蓝色。
【解析】
根据物质的制备原理分析解答;根据物质的分离和提纯原理分析解答;根据沉淀溶解平衡原理进行溶度积的相关计算。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,磁铁成分主要是四氧化三铁;
故答案为:c;
(2)①加入煤炭在空气中“还原焙烧”时产生的有毒气体可能有CO、SO2等;
故答案为:CO、SO2等;
②常温时Ksp[Al(OH)3]=1.0×1032,理论上将Al3+沉淀完全,根据Ksp=c(Al3+)·c3(OH)=1.0×1032,即c(OH)=![]() =10-9mol/L,则c(H+)=
=10-9mol/L,则c(H+)=![]() =10-5mol/L,即pH=5;
=10-5mol/L,即pH=5;
故答案为:5;
③亚铁离子和碳酸氢根离子发生双水解生成FeCO3,离子方程式为:Fe2++2HCO3=FeCO3↓+2CO2↑+H2O;
故答案为:Fe2++2HCO3=FeCO3↓+2CO2↑+H2O;
(3)因为Fe3+会水解产生较多的H+,离子方程式为:Fe3++3H2OFe(OH)3↓ +3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀;
故答案为:Fe(OH)3,Fe3++3H2OFe(OH)3↓+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀;
(4)①由流程图可知,复分解反应ii的离子方程式为:3[Fe(CN)6]4+4Fe3+=Fe4[Fe(CN)6]3↓;
故答案为:3[Fe(CN)6]4+4Fe3+=Fe4[Fe(CN)6]3↓;
②基于普鲁士蓝合成原理可检测食品中CN,碱性条件下,Fe2+与CN结合生成[Fe(CN)6]4,Fe2+被空气中O2氧化生成Fe3+,[Fe(CN)6]4 与Fe3+反应生成普鲁士蓝使试纸显蓝色,
故答案为:碱性条件下,Fe2+与CN结合生成[Fe(CN)6]4,Fe2+被空气中O2氧化生成Fe3+,[Fe(CN)6]4与Fe3+反应生成普鲁士蓝使试纸显蓝色。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:
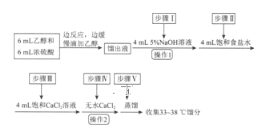

物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
(3)仪器D中盛有冰水混合物,其作用为____________。
(4)操作1的名称为_______________。
(5)若省略步骤Ⅱ会导致的后果是________。