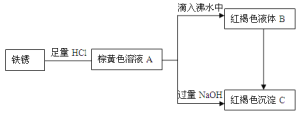
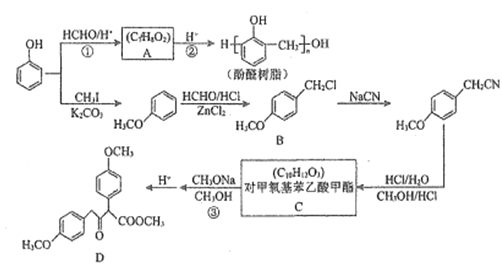
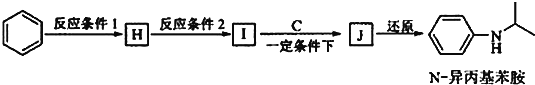
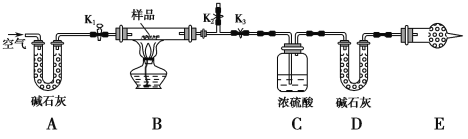
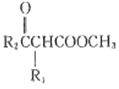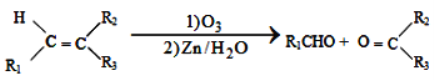题目内容
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)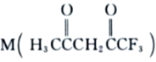 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

【答案】球形、哑铃形(或纺锤形) Br 电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量 三角锥形 PCl3、PBr3、NF3、NCl3等(答一种即可) sp3,sp2 7:1 Ni的原子半径较小,价层电子数目较多,金属键较强 X-射线衍射法 ![]()
【解析】
(1)基态As原子的价层电子排布式为4s24p3, 故其电子云轮廓图形状为球形、哑铃形或纺锤形。一般情况下,同周期主族元素从左到右,元素的第一电离能逐渐增大,故第四周期主族元素中第一电离能最大的是Br。答案为球形、哑铃形(或纺锤形) Br;
(2)①金属元素产生焰色反应的微观原因为电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量,产生焰色反应。答案为电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量;
②AsO33-中As原子的价层电子对数目为4,其立体构型为三角锥形。根据等电子体的含义知,与AsO33-互 为等电子体的分子有PCl3、PBr3、NF3、NCl3等。答案为三角锥形 PCl3、PBr3、NF3、NCl3等(答一种即可);
(3 )由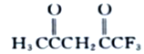 的结构简式可知,一CH3、 一CH2—、一CF3中C原子的价层电子对数目为4,杂化方式为sp3,碳氧双键中C原子的价层电子对数目为3,杂化方式为sp2。每个
的结构简式可知,一CH3、 一CH2—、一CF3中C原子的价层电子对数目为4,杂化方式为sp3,碳氧双键中C原子的价层电子对数目为3,杂化方式为sp2。每个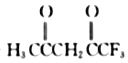 分子中含有14 个
分子中含有14 个![]() 键和2个π键,则
键和2个π键,则![]() 键与π键的数目之比为7:1。答案为sp3,sp2 7:1;
键与π键的数目之比为7:1。答案为sp3,sp2 7:1;
(4)金属晶体熔沸点的高低与金属键的强弱有关,金属键的强弱与价层电子数目和金属原子的半径有关。区分晶体Ni和非晶体Ni的最可靠的科学方法为X-射线衍射法。答案为Ni的原子半径较小,价层电子数目较多,金属键较强 X-射线衍射法;
(5)由晶胞结构可知,每个晶胞中含有2个Ni原子和2个As原子,晶胞的体积V=![]() cm3,故晶胞的密度ρ=
cm3,故晶胞的密度ρ=![]() g·cm-2=
g·cm-2=![]() g·cm-2。答案为
g·cm-2。答案为![]() 。
。

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
C(s)+H20(g)![]() CO(g)+H2(g) △H=+131kJ/mol
CO(g)+H2(g) △H=+131kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H=akJ/mol
CH4(g)+H2O(g) △H=akJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 |
| H-H | H—C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)煤直接甲烷化反应C(s)+2H2(g)![]() CH4(g)的△H为_______kJ/mol,该反应在______(填“髙温”或“低温”)下自发进行。
CH4(g)的△H为_______kJ/mol,该反应在______(填“髙温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:
2C02(g)+6H2(g)![]() C2H4(g)+4H20(g) △H=-128kJ/mol,测得温度对催化剂催化效率和 C02平衡转化率的影响如图所示:
C2H4(g)+4H20(g) △H=-128kJ/mol,测得温度对催化剂催化效率和 C02平衡转化率的影响如图所示:
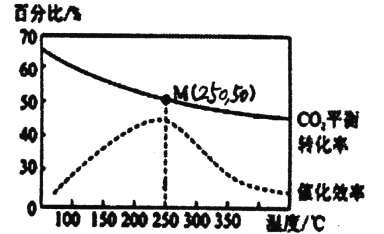
(2)图中低温时,随着温度升高催化剂的催化效率提高,但C02的平衡转化率却反而降低,其原因是__________。
(3)250℃时,该反应的平衡常数K值为__________。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入lmolC02和3molH2,发生反应:C02(g)+3H2(g)![]() CH30H(g)+H20(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH30H(g)+H20(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(4)反应前1小时内的平均反应速率V(H2)为_________mol/(L·h),该温度下C02的平衡转化率为_________。
IV.电解逆转化制乙醇
(5)科研人员通过反复实验发现:C02可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在_________极(“阴”或“阳”),该电极的反应式为_________。