题目内容
9.甲、乙、丙三位同学,分别在相同条件下用乙酸与乙醇反应来制取乙酸乙酯,但未用饱和Na2CO3溶液来吸收.(1)甲、乙、丙同学将得到的酯提纯,在未用指示剂的情况下,他们都先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来.但得到的结果却不同:①甲得到了不溶于水的中性酯;②乙得到显酸性的酯;③丙得到大量水溶性物质.试分析产生上述各种现象的原因.①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;②乙同学加入碱量不足,所以蒸馏出的产物中含过量的酸,得到显酸性的酯;③丙同学加入的碱过量使生成的酯完全水解为可溶性的醇和钠盐.
(2)丁同学为了进一步找出原因,将所得产物进行了分离探究,他的实验操作步骤流程如如图.请你帮他完成该实验并填写下列空白.
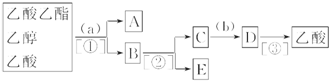
分离出的物质名称:A乙酸乙酯,B乙醇、乙酸钠,C乙酸钠,D乙酸、硫酸钠,E乙醇;
选择的试剂:a饱和碳酸钠溶液,b硫酸;
分离物质的方法:①分液,②蒸馏,③蒸馏.
分析 (1)乙酸乙酯能在碱性条件下水解,加入的碱正好将过量的酸中和,则得到中性的酯;加入碱量不足,有酸剩余,蒸馏后得到酸性酯;加入的碱过量使生成的酯发生了水解;
(2)由分离流程可知,加试剂a为饱和碳酸钠,操作①为分液,得到A为乙酸乙酯;B中含乙醇、乙酸钠,操作②为蒸馏,得到E为乙醇,C中含乙酸钠,加试剂b为硫酸,反应后D中含乙酸和硫酸钠,则操作③为蒸馏,得到乙酸,以此来解答.
解答 解:(1)都先加NaOH中和过量的酸,加入NaOH的量不同得到不同的结果,则①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;②乙同学加入碱量不足,所以蒸馏出的产物中含过量的酸,得到显酸性的酯;③丙同学加入的碱过量使生成的酯完全水解为可溶性的醇和钠盐,
故答案为:①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;②乙同学加入碱量不足,所以蒸馏出的产物中含过量的酸,得到显酸性的酯;③丙同学加入的碱过量使生成的酯完全水解为可溶性的醇和钠盐;
(2)由分离流程可知,加试剂a为饱和碳酸钠,操作①为分液,得到A为乙酸乙酯;B中含乙醇、乙酸钠,操作②为蒸馏,得到E为乙醇,C中含乙酸钠,加试剂b为硫酸,反应后D中含乙酸和硫酸钠,则操作③为蒸馏,得到乙酸,
由上述分析可知物质A.乙酸乙酯,B.乙醇、乙酸钠,C.乙酸钠,D.乙酸、硫酸钠,E.乙醇,
试剂a为饱和碳酸钠溶液,b为硫酸,操作①为分液,②为蒸馏,③为蒸馏,
故答案为:乙酸乙酯;乙醇、乙酸钠;乙酸钠;乙酸、硫酸钠;乙醇;饱和碳酸钠溶液;硫酸;分液;蒸馏;蒸馏.
点评 本题考查混合物的分离、提纯实验设计,为高频考点,把握常见有机物的性质及分离原理、流程等为解答的关键,侧重有机物性质及应用的考查,注意实验流程的分析,题目难度不大.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
4.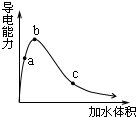 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )| A. | a、b、c三点醋酸的电离程度:c<a<b | |
| B. | a、b、c三点醋酸电离平衡常数:c<a<b | |
| C. | a、b、c三点溶液中的CH+:c<a<b | |
| D. | a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
14.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的三倍.有关下列叙述正确的是( )
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只可能为离子化合物 | |
| C. | Y、Z两元素形成的化合物均会对空气造成污染 | |
| D. | 稳定性:Y的氢化物大于Z的氢化物 |
18.下列叙述中,不正确的是( )
| A. | 共价化合物中不可能含有离子键 | |
| B. | 硫酸分子中有H+和SO42-两种离子 | |
| C. | 某元素原子的最外层只有一个电子,它跟卤素可能形成离子键,也可能形成共价键 | |
| D. | 离子键和共价键的实质都是电性的相互作用 |
19.下列物质中,属于纯净物的是( )
| A. | 白酒 | B. | 陈醋 | C. | 食用调和油 | D. | 蔗糖 |
 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质. .固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-.
.固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-.