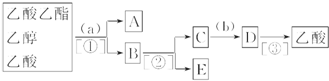
题目内容
1.A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5个,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11.请回答下列问题:(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)SiH4,E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示)S2->Na+>Al3+.
(2)一定条件下,A的单质气体与C的单质气体充分反应生成W气体,W的空间构型为三角锥形.由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的 电子式为
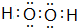 .固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-.
.固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-.(3)G是非金属元素,其单质在电子工业中有重要应用,请写出G的最高价氧化物与B的单质在高温下发生反应的化学反应方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si.
(4)写出E的最高价氧化物的水化物与F单质反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,令F的最外层电子数为x,其质子数为10+x,则D原子最外层电子数为2x,质子数为2+2x,由于F的质子数比D多5,则有:10+x-(2-2x)=5,解得x=3,故F为Al、D为O,C、D、F三种元素的原子序数之和为28,则C的原子序数=28-8-13=7,故C为N;D与H分别为同主族,则H为S;B与G同主族,结合原子序数可知,处于ⅣA族,故B为C、G为Si,据此解答.
解答 解:A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,令F的最外层电子数为x,其质子数为10+x,则D原子最外层电子数为2x,质子数为2+2x,由于F的质子数比D多5,则有:10+x-(2-2x)=5,解得x=3,故F为Al、D为O,C、D、F三种元素的原子序数之和为28,则C的原子序数=28-8-13=7,故C为N;D与H分别为同主族,则H为S;B与G同主族,结合原子序数可知,处于ⅣA族,故B为C、G为Si,
(1)以上八种元素中的非金属中Si的非金属性最弱,其形成的最简单气态氢化物SiH4稳定性最弱,
电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Na+>Al3+,
故答案为:SiH4;S2-;Na+;Al3+;
(2)一定条件下,氢气与氮气充分反应可生成气体W为NH3,其空间构型为三角锥形;由H、O两元素可以组成X、Y两种化合物,X在一定条件下可以分解生成Y,则X为H2O2、Y为H2O,H2O2分子中O原子之间形成1对共用电子对,H原子与O原子之间形成1对共用电子对,其电子式: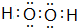 ,固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-,
,固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-,
故答案为:三角锥形;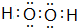 ;Na2O2+2H2O+S2-=S+4Na++4OH-;
;Na2O2+2H2O+S2-=S+4Na++4OH-;
(3)二氧化硅与碳在高温下反应生成CO与Si,化学反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si;
(4)E的最高价氧化物的水化物为氢氧化钠,与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题结构性质位置关系综合应用,涉及元素周期律、比较离子半径、电子式、化学方程式等,难度中等,推断元素是解题的关键.

| 序号 | 物质 | 杂质 | 试剂 | 方法 |
| A | CH3CH2OH | H2O | CaO | 蒸馏 |
| B | CH3COOC2H5 | CH3COOH | CH3CH2OH、浓H2SO4 | 加热 |
| C | 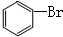 | Br2 | NaOH溶液 | 振荡、静置、分液 |
| D | CH3CH2OH | CH3COOH | NaOH | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
| A. | $\frac{a}{V}$mol/L | B. | $\frac{b}{V}$ mol/L | ||
| C. | $\frac{a-2b}{V}$ mol/L | D. | $\frac{a-b}{V}$mol/L |
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w(m-n)}{m}$ mol | C. | w($\frac{m-n-2}{m}$) mol | D. | w($\frac{m-n+2}{m}$) mol |
| A. | 从上到下,第IA族元素单质的密度逐渐增大 | |
| B. | 从上到下,第IA族元素单质的熔点逐渐降低 | |
| C. | 从上到下,第ⅦA族元素其氢化物的稳定性逐渐增强 | |
| D. | 从上到下,第ⅦA族元素其氢化物的沸点逐渐升高 |
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
| A. | 乙烷和Cl2光照取代 | B. | 乙烯和Cl2加成 | ||
| C. | 乙烯与HCl加成 | D. | 乙烯和H2加成后再与Cl2反应 |
| A. | 氯化钠 | B. | 硫酸亚铁 | C. | 硝酸银 | D. | KOH |