题目内容
7.下列说法错误的是( )| A. | 二氧化碳和环氧丙烷在催化剂作用下可生成一种可降解的高聚物 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 |
分析 A.二氧化碳和环氧丙烷反应生成可降解聚碳酸酯;
B.二氧化硫来源于化石类燃料的燃烧、含硫矿石的冶炼;
C.酶是蛋白质升高温度酶要发生变性;
D.氟利昂能使臭氧生成氧气.
解答 解:A.二氧化碳和环氧丙烷在催化剂作用下生成可降解聚碳酸酯,故A正确;
B.化石类燃料的燃烧、含硫矿石的冶炼等过程是造成SO2污染的重要原因,故B正确;
C.酶是蛋白质升高温度酶要发生变性,失去催化活性,故C错误;
D.氟利昂能使臭氧生成氧气,会破坏臭氧层,大量废气的排放也能使臭氧层出现空洞,故D正确.
故选C.
点评 本题考查环境污染及治理,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,环境的污染和保护是社会关注的焦点问题,注意环境保护,人人有责.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
17.利用实验装置进行相关操作,不能达到相应实验目的是( )
| 序号 | 实验装置 | 实验目的 |
| A | 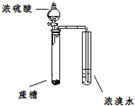 | 证明浓硫酸具有脱水性、氧化性 |
| B | 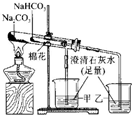 | 比较碳酸钠与碳酸氢钠固体的热稳定性 |
C | 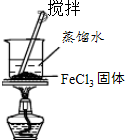 | 制取少量的Fe(OH)3胶体 |
| D | 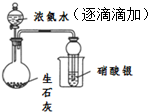 | 证明浓氨水与生石灰作用可制备得到氨气 |
| A. | A | B. | B | C. | C | D. | D |
18.下列事实中,不能说明氯原子得电子能力比硫原子强的是( )
| A. | 盐酸的酸性比氢硫酸(H2S水溶液)酸性强 | |
| B. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS | |
| C. | Cl2能与H2S反应生成S | |
| D. | 还原性:Cl-<S2- |
15.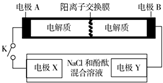 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )| A. | K+从右到左通过离子交换膜 | |
| B. | A的电极反应式为:3I--2e-=I3- | |
| C. | 当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下) | |
| D. | 电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
19.亮菌甲素适用于治疗急性胆囊炎,其结构简式如图所示.下列有关叙述正确的是( )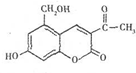

| A. | 亮菌甲素分子式为C12H11O5,属于稠环芳香烃 | |
| B. | 亮菌甲素具有弱酸性,说明羟基对苯环有影响 | |
| C. | 1mol亮菌甲素最多能与2molNaOH发生反应 | |
| D. | 1mol亮菌甲素最多能与5molH2发生加成反应 |
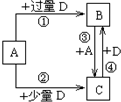
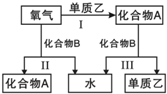 A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题: ;其水溶液呈碱性的原因是NH3+H20
;其水溶液呈碱性的原因是NH3+H20 NH4++OH-(用离子方程式表示).
NH4++OH-(用离子方程式表示).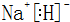 .
. W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题: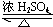 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.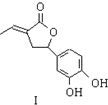 内酯类化合物在药物、涂料等应用广泛.
内酯类化合物在药物、涂料等应用广泛. +$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$
+$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$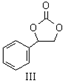
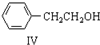 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$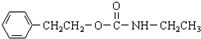 +H2O
+H2O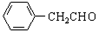 ;由IV生成II的反应条件为浓硫酸、加热.
;由IV生成II的反应条件为浓硫酸、加热.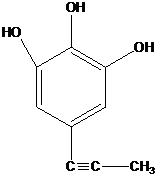 .
.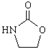 ,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$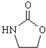 +H2O.
+H2O.