题目内容
16. W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题:(1)元素Z在周期表中的位置为第二周期第ⅥA族.
(2)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,写出该反应的化学方程式:CH3CH2OH+CH3COOH
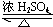 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.(3)由W、X、Y、Z四种元素中的三种元素组成中学化学常见的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)W、Y、Z可组成离子化合物M,M的水溶液呈酸性(填“酸性”或“碱性”或“中性”),M溶液中各离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-);W、Y、Z也可组成中学常见共价化合物N,M和N两种溶液的pH均为 a,那么两溶液中由水电离出的c (H+)的比为1014-2a:1.
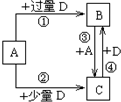
(5)已知由元素X和Z可组成A、B、C、D四种中学化学常见的单质或化合物,四种物质之间存在如图所示的转化关系.已知:298K时,反应①生成1mol B(g)时放出393.5kJ热量,反应④生成1mol B(g)时放出283.0kJ的热量,反应③的热化学方程式为C(s)+CO2(g)=2CO(g)△H=+172.5kJ•mol-1.
分析 W、X、Y、Z是原子序数依次增大的四种短周期元素,W的一种原子的原子核中没有中子,则W为氢元素;元素X 构成的某种单质在自然界中硬度最大,则X为碳元素;元素Z在地壳中含量最高,则Z为氧元素;Y的原子序数介于碳、氧之间,故Y为氮元素.
(1)主族元素周期数=电子层数、主族族序最外层电子数;
(2)由H、C、O三种元素可组成A、B、C三种常见的有机化合物,A和B是日常生活中常用调味品的主要成分,为乙酸、乙醇,二者反应生成乙酸乙酯;
(3)由H、C、N、O四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,应是浓硝酸与碳反应生成二氧化碳、二氧化氮、水;
(4)H、N、O可组成离子化合物M为NH4NO3,铵根离子水解,溶液呈酸性,硝酸根浓度大于铵根离子浓度;
H、N、O也可组成中学常见共价化合物N,N为HNO3,硝酸铵反应中氢离子为水电离产生,硝酸溶液中水电离的氢离子等于溶液中氢氧根离子浓度;
(5)由元素C和O可组成A、B、C、D四种中学化学常见的单质或化合物,由转化关系可知A为碳、D为氧气、B为二氧化碳、C为一氧化碳,根据放出的热量书写反应①、②的热化学方程式,再根据盖斯定律构造目标热化学方程式.
解答 解:W、X、Y、Z是原子序数依次增大的四种短周期元素,W的一种原子的原子核中没有中子,则W为氢元素;元素X 构成的某种单质在自然界中硬度最大,则X为碳元素;元素Z在地壳中含量最高,则Z为氧元素;Y的原子序数介于碳、氧之间,故Y为氮元素.
(1)Z为氧元素,原子核外有2个电子层,最外层电子数为6,处于周期表中第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)由H、C、O三种元素可组成A、B、C三种常见的有机化合物,A和B是日常生活中常用调味品的主要成分,为乙酸、乙醇,二者反应生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH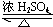 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH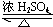 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(3)由H、C、N、O四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,应是浓硝酸与碳反应生成二氧化碳、二氧化氮、水,反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)H、N、O可组成离子化合物M为NH4NO3,铵根离子水解,溶液呈酸性,硝酸根浓度大于铵根离子浓度,离子浓度为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
H、N、O也可组成中学常见共价化合物N,N为HNO3,NH4NO3和HNO3两种溶液的pH均为 a,硝酸铵反应中氢离子为水电离产生,溶液中由水电离出的c (H+)=10-amol/L,硝酸溶液中水电离的氢离子等于溶液中氢氧根离子浓度,溶液中由水电离出的c (H+)=$\frac{1{0}^{-14}}{1{0}^{-a}}$mol/L=10-14+amol/L,两溶液中由水电离出的c (H+)的比为 10-amol/L:10-14+amol/L=1014-2a:1,
故答案为:酸性;c(NO3-)>c(NH4+)>c(H+)>c(OH-);1014-2a:1;
(5)由元素C和O可组成A、B、C、D四种中学化学常见的单质或化合物,由转化关系可知A为碳、D为氧气、B为二氧化碳、C为一氧化碳,反应③为C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO,
298K时,反应①生成1mol B(g)时放出393.5kJ热量,反应④生成1mol B(g)时放出283.0kJ的热量,则:
①C(s)+O2(g)=2CO2(g)△H=-393.5kJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-283.0kJ•mol-1
根据盖斯定律,②×2-①得:反应③的热化学方程式为:C(s)+CO2(g)=2CO(g)△H=+172.5kJ•mol-1,
故答案为:C(s)+CO2(g)=2CO(g)△H=+172.5kJ•mol-1.
点评 本题考查元素化合物推断等,涉及化学方程式书写、热化学方程式书写、离子浓度比较、溶液pH有关计算等,推断元素是解题的关键,难度中等,是对学生综合能力的考查,难需要学生具备扎实的基础,难度中等.

| A. | 干电池 | B. | 锂电池 | C. | 太阳能电池 | D. | 铅蓄电池 |
| A. | 二氧化碳和环氧丙烷在催化剂作用下可生成一种可降解的高聚物 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 |
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
①反应刚开始,仅有少量气泡产生;
②反应片刻后,有大量气泡产生;
③试管底部最终出现红褐色沉淀.下列判断正确的是( )
| A. | ①中仅发生一个反应 | |
| B. | Fe3+能催化H2O2的分解 | |
| C. | 反应过程中溶液pH不断减小 | |
| D. | FeSO4与等物质的量的H2O2恰好反应 |
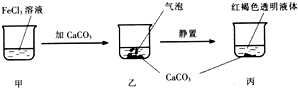
| A. | 乙中产生的气泡是C02 | |
| B. | 丙中液体可产生丁达尔现象 | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl-)不发生变化 | |
| D. | 若将CaC03换成CaS04也可得到相同的实验现象 |
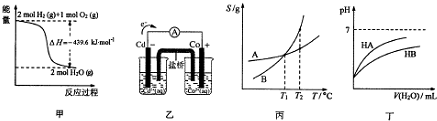
| A. | 由甲推知氢气的燃烧热为219.8kJ•mol-1 | |
| B. | 由乙推知离子反应Co2+(ap)+Cd(s)═Co(s)+Cd2+(ap)可以发生 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温T2℃时,溶质的质量分数:B>A | |
| D. | 由丁可知:同温度、同浓度NaA溶液与NaB溶液相比,其pH:NaA>NaB |
| 选项 | 事实 | 化学方程式 |
| A | 常温下,可用铝制容器盛放浓硝酸 | A l+3HNO3(浓)=Al(OH)3+3NO2↑ |
| B | 可用生石灰做工业废气脱硫酸 | 2CaO+2SO2+O2=2CaSO4 |
| C | 电解MgCl2溶液冶炼Mg | MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ |
| D | 侯德榜用饱和食盐水、氨水、CO2制备纯碱 | 2NaCl+2NH3+CO2+H2O=2NH4Cl+NaCO3 |
| A. | A | B. | B | C. | C | D. | D |
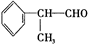 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下: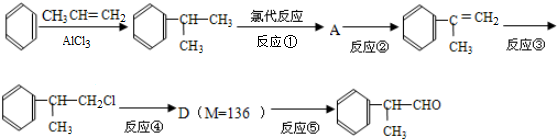
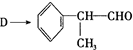 反应的化学方程式为2
反应的化学方程式为2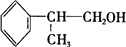 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2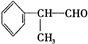 +2H2O.
+2H2O.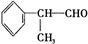 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$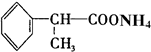 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.