题目内容
15.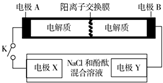 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )| A. | K+从右到左通过离子交换膜 | |
| B. | A的电极反应式为:3I--2e-=I3- | |
| C. | 当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下) | |
| D. | 电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
分析 当闭合开关K时,X附近溶液先变红,即X附近有氢氧根生成,所以在X极上得电子析出氢气,X极是阴极,Y极是阳极.与阴极连接的是原电池的负极,所以A极是负极,B极是正极,再根据原电池、电解池原理判断选项.
解答 解:当闭合开关K时,X附近溶液先变红,即X附近有氢氧根生成,所以在X极上得电子析出氢气,X极是阴极,Y极是阳极.与阴极连接的是原电池的负极,所以A极是负极,B极是正极.
A、闭合K时,A是负极B是正极,电子从A极流向B极,根据异性电荷相吸原理,所以K+从左到右通过离子交换膜,故A错误.
B、闭合K时,A是负极,负极上失电子发生氧化反应,电极反应式为2K2S2-2e-═K2S4+2K+,故B错误.
C、闭合K时,当有0.1molK+通过离子交换膜,即有0.1mol电子产生,X极上得电子析出氢气,反应式为 2H++2e-=H2↑,所以生成的氢气体积为$\frac{0.1mol}{2}$×22.4L/mol=1.12L(标况下),故C正确.
D、电池充电时,B电极要与外电源的正极相连,作为阳极,发生氧化反应,故D错误.
故选C.
点评 本题考查了原电池及电解池工作原理,有些难度,能准确判断各电极的名称及电极反应是解本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列对事实的解释或结论不正确的是( )
| 事实 | 解释或结论 | |
| A | 向Na2CO3浓溶液中通入足量CO2溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| B | 常温下相同浓度NaHCO3溶液的pH大于NaHSO3的pH | 酸性:H2CO3<H2SO3 |
| C | 向2mL 1mol/LAlCl3溶液中加入几滴1mol/LNaOH溶液,生成白色沉淀,再加入几滴1mol/LFeCl3溶液,沉淀变为红褐色 | Ksp:Al(OH)3>Fe(OH)3 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
6.下列不属于化学电源的是( )
| A. | 干电池 | B. | 锂电池 | C. | 太阳能电池 | D. | 铅蓄电池 |
10.化学与环境密切相关,下列有关说法正确的是( )
| A. | 雾霾是一种自然现象,对人体健康影响不大 | |
| B. | PM2.5是指大气中直径小于或等于2.5μm的颗粒物 | |
| C. | 大气中SO2含量的增加会导致温室效应加剧 | |
| D. | 酸雨是pH小于7的雨水 |
20.下列叙述正确的是( )
| A. | SO32-中硫原子的杂化方式为sp3 | B. | H2O分子中氧原子的杂化方式为sp2 | ||
| C. | BF3分子呈三角锥体空间型 | D. | C2H2分子中含有3个σ键和2个π键 |
7.下列说法错误的是( )
| A. | 二氧化碳和环氧丙烷在催化剂作用下可生成一种可降解的高聚物 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 |
4.分子式为C4H9ClO的有机物,能与金属钠反应放出氢气的同分异构体数目有( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
5.化学与生产、生活密切相关.下列与化学有关的事实及其相关化学方程式的书写都正确的是( )
| 选项 | 事实 | 化学方程式 |
| A | 常温下,可用铝制容器盛放浓硝酸 | A l+3HNO3(浓)=Al(OH)3+3NO2↑ |
| B | 可用生石灰做工业废气脱硫酸 | 2CaO+2SO2+O2=2CaSO4 |
| C | 电解MgCl2溶液冶炼Mg | MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ |
| D | 侯德榜用饱和食盐水、氨水、CO2制备纯碱 | 2NaCl+2NH3+CO2+H2O=2NH4Cl+NaCO3 |
| A. | A | B. | B | C. | C | D. | D |
 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.