题目内容
5.下列冶炼金属的原理不正确的是( )| A. | 电解饱和食盐水制备金属钠 | B. | 加热分解Ag2O制备金属银 | ||
| C. | Fe2O3与CO高温下反应制备金属铁 | D. | Cu2S与O2高温下反应制备金属铜 |
分析 电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得.
解答 解:A.Na是活泼金属,如果电解饱和食盐水,阴极上氢离子放电生成氢气,得不到钠,应该电解熔融氯化钠冶炼,故A错误;
B.Ag是不活泼金属,采用热分解法冶炼,故B正确;
C.Fe是较不活泼金属,采用热还原法冶炼,故C正确;
D.Cu是较不活泼金属,采用热还原法冶炼,故D正确;
故选A.
点评 本题考查金属的冶炼,为高频考点,明确金属活泼性强弱与冶炼方法的关系是解本题关键,知道常见金属冶炼方法,题目难度不大.

练习册系列答案
相关题目
16.已知某有机物9.2g与足量氧气在密闭容器中完全燃烧后,将反应生成的气体依次通过浓硫酸和碱石灰.浓硫酸增重10.8g,碱石灰增重17.6g,该有机物的化学式是( )
| A. | CH4O | B. | C2H4O | C. | C2H6O | D. | C2H6O2 |
20.下列各组元素中,位于同一周期的是( )
| A. | 硅、硫、氯 | B. | 锂、钠、钾 | C. | 氟、氯、溴 | D. | 碳、氧、铝 |
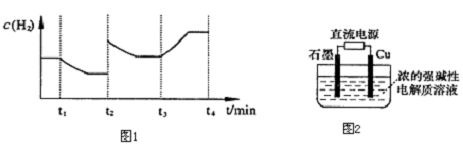
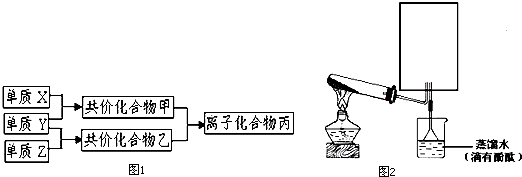
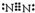 .
.
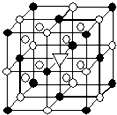 冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )
冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )