题目内容
6.下列反应中能用离子方程式H++OH -═H2O表示的是( )| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 硝酸溶液和烧碱溶液反应 | ||
| C. | 醋酸和KOH溶液反应 | D. | 盐酸和氢氧化铁反应 |
分析 离子方程式H++OH-═H2O表示强酸和强碱反应生成可溶性的盐和水的一类反应,结合硫酸钡、醋酸、氢氧化铁在离子反应中保留化学式来解答.
解答 解:A.硫酸与Ba(OH)2溶液反应生成硫酸钡和水,硫酸钡不溶于水,反应的离子反应为:SO42-+2H++Ba2++2OH-=2H2O+BaSO4↓,不能用H++OH-=H2O表示,故A错误;
B.硝酸与氢氧化钠溶液反应的离子反应为:H++OH-=H2O,故B正确;
C.醋酸与氢氧化钾溶液反应的离子反应为:HAc+OH-=H2O+Ac-,不能用H++OH-=H2O表示,故C错误;
D.氢氧化铁难溶于水,盐酸和氢氧化铁反应的离子方程式为:3H++Fe(OH)3=Fe3++3H2O,不能用H++OH-=H2O表示,故D错误;
故选B.
点评 本题考查离子反应方程式书写的判断,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
16.已知某有机物9.2g与足量氧气在密闭容器中完全燃烧后,将反应生成的气体依次通过浓硫酸和碱石灰.浓硫酸增重10.8g,碱石灰增重17.6g,该有机物的化学式是( )
| A. | CH4O | B. | C2H4O | C. | C2H6O | D. | C2H6O2 |
14.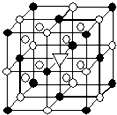 冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )
冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )
 冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )
冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )| A. | Na+ | B. | Al3+ | C. | F- | D. | AlF6- |
1.下列说法正确的是( )
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 用pH试纸测得某新制氯水的pH为2 | |
| C. | 有单质生成的反应一定为氧化还原反应 | |
| D. | CuSO4•5H2O是一种混合物 |
11.在下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 0.5L0.1mol/L的NaCl溶液 | B. | 1L0.2mol/L的MgCl2溶液 | ||
| C. | 1L0.3mol/L盐酸溶液 | D. | 100mL0.2mol/L的AlCl3溶液 |
18.现有三种常见的治疗胃病的药品标签:
INDICALM消化药片每片含250mg碳酸钙
Stomachease减缓胃痛每片含250mg氢氧化镁
Fast digestion帮助消化每片含250mg氧化镁
药品中所含的物质均能与胃里过量的盐酸反应,则相同粒数的三种药片消耗HCl的物质的量比较,正确的是( )
INDICALM消化药片每片含250mg碳酸钙
Stomachease减缓胃痛每片含250mg氢氧化镁
Fast digestion帮助消化每片含250mg氧化镁
药品中所含的物质均能与胃里过量的盐酸反应,则相同粒数的三种药片消耗HCl的物质的量比较,正确的是( )
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
16.下列装置或操作不能达到实验目的是( )
| A. | 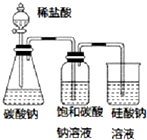 图中的实验现象能证明非金属性:Cl>C>Si | |
| B. | 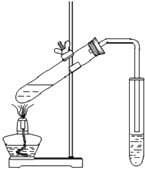 图可用于实验室制备并收集乙酸乙酯 | |
| C. |  图中,气体从a口进入时,可用于收集H2、CH4、NH3等气体 | |
| D. | 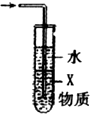 图中X若为CCl4,可用于吸收NH3或HCl |
