题目内容
3.(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:①混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=9.9×10-7mol/L.
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH<7.(填“>7”、“<7”、或“无法确定”)
(4)(Ⅰ)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下表所示.
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00[来 |
②下列情况可能引起测定结果偏高的是AD.
A、酸式滴定管未用标准盐酸溶液润洗
B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定前,滴定管中的溶液液面最低点在“0”点以下
(Ⅱ)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
A.KBr B.KI C.K2S D.K2CrO4.
分析 (Ⅰ)(1)①酸或碱能抑制水电离,含有弱根离子的盐促进水电离;
②根据物料守恒和电荷守恒分析;
(2)二者混合得到等物质的量浓度的MCl和MOH,混合溶液呈酸性,说明碱的电离程度小于盐的水解程度;
(3)pH=3的HR溶液与pH=11的NaOH溶液,两种溶液中c(H+)=c(OH-),如HR为强酸,则反应后呈中性,如为弱酸,则反应后呈酸性;
(4)据表分析,实验1的数据与实验2实验3 差别太大,可忽略,求出实验2和实验3 的平均值,即为所用标准液的体积,再据c(NaOH)=$\frac{c(HCl)•V(HCl)}{V(NaOH)}$求算及误差分析;
(Ⅱ)滴定实验是利用沉淀变色指示反应沉淀完全,在氯化银刚好沉淀完成,再滴加硝酸银溶液,与指示剂作用生成不同现象来进行判断;测定水体中氯化物的含量,必须使氯离子完全生成白色沉淀,指示沉淀反应完全的试剂溶解性一定小于氯化银,所以本题应在Ag+和Cl-生成AgCl沉淀后,再生成不同颜色沉淀指示沉淀终点.则指示剂的溶解度应比AgCl大来分析判断.
解答 解:(Ⅰ)①酸或碱能抑制水电离,含有弱根离子的盐促进水电离,所以混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+),
故答案为:>;
②根据电荷守恒得c(Cl-)+c(OH-)=c(M+)+c(H+),所以:c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8mol/L=9.9×10-7mol/L;
故答案为:9.9×10-7;
(2)二者混合得到等物质的量浓度的MCl和MOH,混合溶液呈酸性,说明碱的电离程度小于盐的水解程度,
故答案为:<;
(3)HR若为强电解质,二者都是一元酸或碱,等体积混合后溶液的pH=7,而混合溶液的pH≠7,说明HR为弱电解质,二者混合后溶液中酸过量,反应后溶液显示酸性,溶液pH<7,
故答案为:<7;
(4)①第二组数据误差较大,应该舍弃,则另外两次消耗盐酸的平均体积为:V(HCl)=$\frac{27.83+27.85}{2}$mL,则c(NaOH)=$\frac{c(HCl)•V(HCl)}{V(NaOH)}$=$\frac{0.1032mol/L×\frac{27.83}{2}×1{0}^{-3}L}{0.025L}$=$\frac{0.0132×\frac{27.83+27.85}{2}}{25}$mol/L,
故答案为:$\frac{0.0132×\frac{27.83+27.85}{2}}{25}$;
②A.酸式滴定管未用标准盐酸溶液润洗,所用V(HCl)偏大,引起测定结果偏高,故A正确;
B.锥形瓶未用待测液润洗,无影响,故B错误;
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了,所用V(HCl)偏大,引起测定结果偏高,故C正确;
D.滴定前,滴定管中的溶液液面最低点在“0”点以下,无影响,故D错误;
故答案为:AC;
(Ⅱ)本题的指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示沉淀终点;
A.氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A错误;
B.依据A分析可知碘化银优先于氯化银析出,不能测定氯化物的含量,故B错误;
C.硫化银的Ksp很小,Ksp=[Ag+]2[S2-]=2.0×10-48,计算得到需要的银离子浓度[S2-]=$\root{3}{\frac{2.0×1{0}^{-48}}{4}}$;Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,[Cl-]=$\sqrt{1.8×1{0}^{-10}}$,通过计算得出硫化银也比氯化银先沉淀,故C错误;
D.铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=2.0×10-12,[Cl-]=$\sqrt{1.8×1{0}^{-10}}$,[CrO42-]=$\root{3}{\frac{2.0×1{0}^{-12}}{4}}$;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,做指示剂可以正确的测定氯化物的含量,故D正确;
故答案为:D.
点评 本题考查了酸碱混合的定性判断及有关pH的计算、沉淀溶解平衡的计算判断等知识,题目难度中等,注意掌握电荷守恒、物料守恒、质子守恒的含义及应用方法,明确酸碱混合的定性判断方法及溶液pH的计算方法.

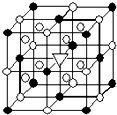 冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )
冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )| A. | Na+ | B. | Al3+ | C. | F- | D. | AlF6- |
| A. | 0.5L0.1mol/L的NaCl溶液 | B. | 1L0.2mol/L的MgCl2溶液 | ||
| C. | 1L0.3mol/L盐酸溶液 | D. | 100mL0.2mol/L的AlCl3溶液 |
INDICALM消化药片每片含250mg碳酸钙
Stomachease减缓胃痛每片含250mg氢氧化镁
Fast digestion帮助消化每片含250mg氧化镁
药品中所含的物质均能与胃里过量的盐酸反应,则相同粒数的三种药片消耗HCl的物质的量比较,正确的是( )
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
| A. | $\frac{a+b-2c}{4}$kJ | B. | $\frac{a+2b-4c}{8}$kJ | C. | $\frac{b-a-2c}{4}$kJ | D. | $\frac{2b-a-4c}{8}$kJ |
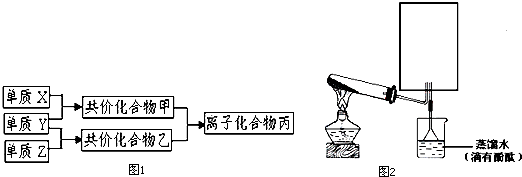
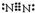 .
. 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: