题目内容
2.Fe3+、SO42-、Al3+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,X可能是( )| A. | Br- | B. | OH- | C. | HCO3- | D. | NH4+ |
分析 根据溶液呈电中性可知,阳离子带的电荷总数等于阴离子带的电荷总数来计算,然后结合离子的共存来分析解答.
解答 解:由Fe3+、SO42、Al3+和X四种离子以物质的量之比2:4:1:1,
由溶液呈电中性可知,Fe3+和Al3+所带电荷总数大于SO42带的电荷数,
设X离子带的负电荷数为x,则
3×2+3×1=2×4+x×1,解得x=1,
即X为带1个单位负电荷的阴离子,又OH-或HCO3-与Fe3+、Al3+结合生成沉淀或气体,不能共存于同一溶液,
故X可能为Br-,
故选:A.
点评 本题考查学生利用溶液不显电性及离子的共存来判断溶液中离子,学生容易忽略离子的共存而错选B答案.

练习册系列答案
相关题目
12.下列叙述不正确的是( )
| A. | 分散质粒子的半径在10-9m~10-7m之间的分散系叫做胶体 | |
| B. | 少量金属钠可保存在煤油中 | |
| C. | CO2水溶液能导电,因此CO2是电解质 | |
| D. | 汤姆生、卢瑟福、玻尔等科学家对原子结构模型的提出作出了很大贡献 |
13.下列实验方法能达到实验目的是( )
| A. | 用丁达尔效应可以鉴别溶液和胶体 | |
| B. | 用分液漏斗分离碘与CCl4的混合液 | |
| C. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| D. | 某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Cu2+ |
10.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,23gNO2和N2O4的混合气体中含有的N原子数目为0.75NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
17.下列说法中,不正确的是( )
| A. | 草酸能使酸性高锰酸钾溶液褪色 | |
| B. | MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 | |
| C. | 要判断反应进行的方向,必须综合考虑体系的焓变和熵变 | |
| D. | 用稀硫酸和Zn反应制H2时,加少量CuSO4溶液对反应速率无影响 |
7.下列事实不能说明非金属性Cl>I的是( )
| A. | Cl2+2I-→2Cl-+I2 | B. | 酸性:HClO3>HIO3 | C. | 酸性:HClO4>HIO4 | D. | 稳定性:HCl>HI |
14.除去KNO3中少量的NaCl和沙子,必要的操作步骤是( )
| A. | 过滤、蒸馏、萃取 | B. | 过滤、结晶、升华 | C. | 分液、溶解、萃取 | D. | 溶解、过滤、结晶 |
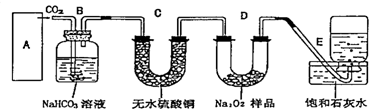
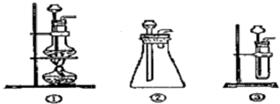
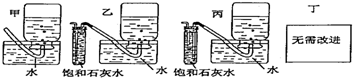
 +CaCl2+H2O
+CaCl2+H2O