题目内容
12.下列叙述不正确的是( )| A. | 分散质粒子的半径在10-9m~10-7m之间的分散系叫做胶体 | |
| B. | 少量金属钠可保存在煤油中 | |
| C. | CO2水溶液能导电,因此CO2是电解质 | |
| D. | 汤姆生、卢瑟福、玻尔等科学家对原子结构模型的提出作出了很大贡献 |
分析 A、依据分散系的本质特征是微粒直径大小分析;
B、根据钠易和氧气、水等反应,密度大于煤油分析;
C、电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物;
D、汤姆生发现电子、卢瑟福α粒子散射、玻尔的波尔理论等,这些科学家对原子结构模型做出了很大的贡献.
解答 解:A、分散质粒子的半径在10-9m~10-7m之间的分散系叫做胶体,故A正确;
B、钠易和氧气、水等反应,密度大于煤油,少量金属钠可保存在煤油中,防止和空气接触,故B正确;
C、二氧化碳在水溶液中与水反应生成碳酸,碳酸电离出自由移动的离子导电,二氧化碳自身不能电离,是非电解质,故C错误;
D、汤姆生发现电子、卢瑟福α粒子散射、玻尔的波尔理论等,这些科学家对原子结构模型做出了很大的贡献,故D正确;
故选C.
点评 本题考查了分散系,物质的性质、电解质以及原子结构的分析判断,注意概念的掌握,题目难度中等.

练习册系列答案
相关题目
7.已知H2(g)+I2(g)?2HI(g)△H<0有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
| A. | 甲温度不变、乙降低温度 | |
| B. | 甲中加入0.1mol He,乙不改变 | |
| C. | 甲增加0.1mol H2,乙增加0.1mol I2(g) | |
| D. | 甲降低温度,乙温度不变 |
17.下列行为符合安全要求的是( )
| A. | 配制稀硫酸时将水倒入浓硫酸中并不断搅拌 | |
| B. | 不慎洒出的酒精在桌上着火时,立即用水扑灭 | |
| C. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 | |
| D. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 |
4.据环保部门测定,我国一些大城市的酸雨pH约为3.5.在酸雨季节铁制品极易腐蚀,下列说法正确的是( )
| A. | 腐蚀中正极反应为:2H++2e-=H2↑ | |
| B. | 腐蚀中负极反应为:Fe-3e-=Fe3+ | |
| C. | 钢铁设备上连接铜块可以防止腐蚀 | |
| D. | 钢铁与外加直流电源的正极相连可以防止腐蚀 |
1.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| B. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 乙烯和环丙烷组成的28g混合气体中氢原子的个数为4NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
2.Fe3+、SO42-、Al3+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,X可能是( )
| A. | Br- | B. | OH- | C. | HCO3- | D. | NH4+ |

 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基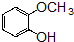
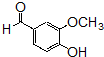 的同分异构体的结构简式
的同分异构体的结构简式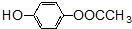
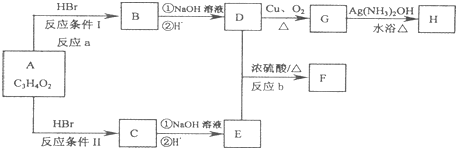
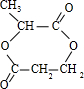 +2H2O
+2H2O