题目内容
18.如图为探究铁的性质的装置,装置中间的漏斗与空气相通,R为电源,则下列判断正确的是( )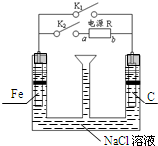
| A. | 若只关闭K1,则Fe发生析氢腐蚀 | |
| B. | 先只关闭K1,漏斗内液面下降,且有红褐色沉淀产生;再打开K1,仅关闭K2,则液面上升 | |
| C. | 若只关闭K2,只有一个电极产生气体,则a为电源负极 | |
| D. | 只关闭K1时,发生的总反应方程式为:2Fe+O2+2H2O═2Fe(OH)2 |
分析 A.若只关闭K1,形成原电池,但由于电解质溶液为中性的氯化钠溶液,所以发生吸氧腐蚀;
B.若只关闭K1,形成原电池,发生吸氧腐蚀,再打开K1,仅关闭K2,形成电解池,根据电极反应判断漏斗液面变化;
C.若只关闭K2,形成电解池,只有一个电极产生气体,则铁为阳极;
D.只关闭K1时,形成原电池,但由于电解质溶液为中性的氯化钠溶液,所以发生吸氧腐蚀.
解答 解:A.若只关闭K1,形成原电池,但由于电解质溶液为中性的氯化钠溶液,所以发生吸氧腐蚀,故A错误;
B.若只关闭K1,形成原电池,但由于电解质溶液为中性的氯化钠溶液,所以发生吸氧腐蚀,发生的总反应方程式为:2Fe+O2+2H2O═2Fe(OH)2,消耗水所以漏斗内液面下降,但出现白色的氢氧化亚铁沉淀,再打开K1,仅关闭K2,形成电解池,产生气体,则漏斗内液面又上升,故B错误;
C.若只关闭K2,形成电解池,只有一个电极产生气体,则铁为阳极,所以a为正极,故C错误;
D.只关闭K1时,形成原电池,但由于电解质溶液为中性的氯化钠溶液,所以发生吸氧腐蚀,发生的总反应方程式为:2Fe+O2+2H2O═2Fe(OH)2,故D正确;
故选:D.
点评 本题考查了原电池和电解池原理,难度较大,注意:如果电解池的阳极材料是活泼电极,则电解池工作时,阳极材料放电而不是电解质溶液中的阴离子放电,为易错点.

练习册系列答案
相关题目
6.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离原子核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl非金属性和最高价氧化物对应的水化物的酸性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
3.下列各组离子在指定分散系中一定能大量共存的是( )
| A. | 明矾溶液中:Na+、Mg2+、NO3-、HCO3- | |
| B. | 澄清透明的溶液中:Na+、K+、MnO4-、ClO- | |
| C. | pH=0的溶液中:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- |
10.25℃时,0.1mol/L 的CH3COOH溶液pH=3,0.1mol/L 的HCN溶液pH=4.下列说法正确的是( )
| A. | CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH | |
| B. | 25℃时,水电离出来的c(H+)均为 10-9mol/L的两种酸,酸的浓度:HCN>CH3COOH | |
| C. | 25℃时,浓度均为0.1mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN | |
| D. | 25℃时,量取100m LpH=3的CH3COOH溶液加水稀释到1000m L,所得溶液由水电离的c(OH-)>10-10mol/L. |


 ;D→E的反应类型取代反应.
;D→E的反应类型取代反应. .
. .
. )的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br
)的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br
 硼是新型无机材料中的明星元索.
硼是新型无机材料中的明星元索. .
. 2,3,4-三甲基-3-乙基己烷
2,3,4-三甲基-3-乙基己烷 4-甲基-2-戊烯
4-甲基-2-戊烯 乙苯
乙苯


 .
.