题目内容
15.溴水中存在化学平衡:Br2+H2O═HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示).已知:R-CH2Cl+NaOH(水溶液)→R-CH2OH+NaCl

回答下列问题:
(1)写出B中所含官能团名称溴原子和羟基,
(2)指出③的反应类型取代反应,写出I(环状)的结构简式
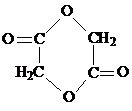 .
.(3)写出反应 ①的化学方程式
 .写出反应 ②的化学方程式
.写出反应 ②的化学方程式 .
.
分析 E是醚,C发生取代反应生成醚,则C结构简式为HOCH2CH2OH,A发生取代反应生成B,则A为BrCH2CH2Br;
溴和水反应生成氢溴酸和次溴酸,氢溴酸和乙烯发生加成反应生成溴乙烷,次溴酸和乙烯发生加成反应生成B,B的结构简式为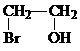
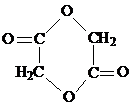
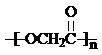
解答 解:E是醚,C发生取代反应生成醚,则C结构简式为HOCH2CH2OH,A发生取代反应生成B,则A为BrCH2CH2Br;
溴和水反应生成氢溴酸和次溴酸,氢溴酸和乙烯发生加成反应生成溴乙烷,次溴酸和乙烯发生加成反应生成B,B的结构简式为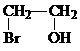
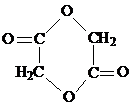
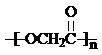
(1)B为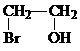
(2)③的反应类型取代反应,I(环状)的结构简式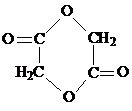 ,
,
故答案为:取代反应;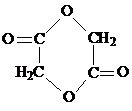 ;
;
(3)反应①的化学方程式 ,反应②的化学方程式
,反应②的化学方程式 ,
,
故答案为: ;
; .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力及知识运用能力,正确理解溴和水反应产物性质是解本题关键,根据产物结合反应条件进行推断,熟练掌握常见有机反应类型、反应条件,易错点是(3)题缩聚反应方程式的书写.

| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离原子核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl非金属性和最高价氧化物对应的水化物的酸性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
| A. | 明矾溶液中:Na+、Mg2+、NO3-、HCO3- | |
| B. | 澄清透明的溶液中:Na+、K+、MnO4-、ClO- | |
| C. | pH=0的溶液中:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- |
| A. | CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH | |
| B. | 25℃时,水电离出来的c(H+)均为 10-9mol/L的两种酸,酸的浓度:HCN>CH3COOH | |
| C. | 25℃时,浓度均为0.1mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN | |
| D. | 25℃时,量取100m LpH=3的CH3COOH溶液加水稀释到1000m L,所得溶液由水电离的c(OH-)>10-10mol/L. |
| A. | 25℃,Cu(OH)2在水中的溶度积比其在Cu(NO3)2溶液中的大 | |
| B. | 氨水溶液加水稀释,电离程度增大,c(OH-)增大 | |
| C. | 25℃,为使100mlpH=2的醋酸溶液pH变为3,可加入900ml 水 | |
| D. | CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
 2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( )
2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( )| A. | CO、CO2均属于酸性氧化物 | |
| B. | 形成化学键时需吸收能量 | |
| C. | 钌催化剂可以改变该反应的焓变 | |
| D. | CO与O形成化学键过程中有电子转移 |
 硼是新型无机材料中的明星元索.
硼是新型无机材料中的明星元索. .
.