题目内容
10.制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”.“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+.在实验室里,用“烂板液”制取ZnSO4•7H2O的过程如下:
(1)稀硝酸腐蚀锌板时表现出的性质是氧化性、酸性.
(2)与Al(OH)3相似,Zn(OH)2也是两性氢氧化物,若步骤①的pH>12,则Zn(OH)2会溶解.写出Zn(OH)2被溶解的离子方程式Zn(OH)2+2OH-=[Zn(OH)4]2-.
(3)滤液D中除了含有OH-离子外,还含有的阴离子有Cl-、NO3-(填离子符号).
(4)步骤②中用蒸馏水多次洗涤的目的是洗去附着在沉淀上的Na+、Cl-、NO3-等可溶性杂质离子,排除干扰.
(5)步骤③要控制pH在一定范围.实验室用pH试纸测定溶液pH的方法是:把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒醮取待测溶液点在试纸的中部,试纸颜色变化稳定后,与标准比色卡对比,读出pH值.
(6)已知:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq)△H=a kJ•mol-1
H2O(l)?H+(aq)+OH-(aq)△H=b kJ•mol-1
请写出Fe3+发生水解反应的热化学方程式:Fe3+(aq)+3H2O(l)?Fe(OH)3(aq)+3H+(aq)△H=(3b-a)kJ•mol-1.
分析 烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子转化为Fe(OH)3、Zn(OH)2沉淀,过滤分离,滤液C中含有NaNO3、NaCl等,沉淀会附着NaNO3、NaCl等,用水洗涤除去,沉淀B用硫酸溶解、控制一定pH,Fe(OH)3不溶解,过滤分离得到ZnSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O.
(1)稀硝酸与Zn反应生成硝酸锌及氮的还原产物;
(2)Zn(OH)2溶解生成四羟基合锌酸钠;
(3)溶液中D含有NaNO3、NaCl等,
(4)沉淀会附着NaNO3、NaCl等,需用水洗涤除去;
(5)实验室用pH试纸测定溶液pH的方法是:把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒醮取待测溶液点在试纸的中部,试纸颜色变化稳定后,与标准比色卡对比,读出pH值;
(6)利用盖斯定律,由已知热化学方程式乘以合适的系数进行加减,构造目标热化学方程式.
解答 解:烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子转化为Fe(OH)3、Zn(OH)2沉淀,过滤分离,滤液C中含有NaNO3、NaCl等,沉淀会附着NaNO3、NaCl等,用水洗涤除去,沉淀B用硫酸溶解、控制一定pH,Fe(OH)3不溶解,过滤分离得到ZnSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O.
(1)若稀硝酸腐蚀锌板,反应生成Zn(NO3)2、N元素还原产物,部分N元素化合价不变、部分N元素化合价由+5价变为+2价,所以反应中硝酸起氧化性、酸性作用,
故答案为:氧化性、酸性;
(2)Zn(OH)2溶解生成四羟基合锌酸钠,反应的离子方程式为Zn(OH)2+2OH-=[Zn(OH)4]2-,
故答案为:Zn(OH)2+2OH-=[Zn(OH)4]2-;
(3)沉淀A会附着NaNO3、NaCl等,洗涤后滤液D中除了含有OH-离子外,还含有Cl-、NO3-,
故答案为:Cl-、NO3-;
(4)沉淀A会附着NaNO3、NaCl等,需用水洗去附着在沉淀上的Na+、Cl-、NO3-等可溶性杂质离子,排除干扰,
故答案为:洗去附着在沉淀上的Na+、Cl-、NO3-等可溶性杂质离子,排除干扰;
(5)测定溶液pH时,把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒醮取待测溶液点在试纸的中部,试纸颜色变化稳定后,与标准比色卡对比,读出pH值,
故答案为:把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒醮取待测溶液点在试纸的中部,试纸颜色变化稳定后,与标准比色卡对比,读出pH值;
(6)Fe3+发生水解反应的方程式为:Fe3++3H2O?Fe(OH)3+3H+,
已知:①Fe(OH)3(s)?Fe3+(aq)+3OH-(aq)△H=akJ•mol-1
②H2O(l)?H+(aq)+OH-(aq)△H=bkJ•mol-1,
根据盖斯定律,②×3-①可得:Fe3+(aq)+3H2O(l)?Fe(OH)3(aq)+3H+(aq)△H=(3b-a)kJ•mol-1,
故答案为:Fe3+(aq)+3H2O(l)?Fe(OH)3(aq)+3H+(aq)△H=(3b-a)kJ•mol-1.
点评 本题考查物质制备方案、对操作的分析评价、物质的分离提纯、热化学方程式书写等,为高考常见题型,侧重于学生的分析能力、实验能力的考查,难度中等.

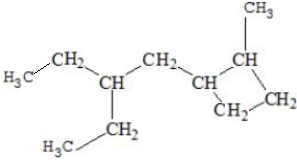
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCH3 | D. | CH3C≡CH |
| A. | 无色透明的溶液中:HCO3-、K+、Na+、MnO4- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 含有0.1 mol•L-1 Fe3+的溶液中可以大量存在:K+、Mg2+、I-、NO3- | |
| D. | 室温下,pH=l的溶液中一定可以存在:Na+、Fe3+、NO3-、SO42- |
| A. | 上述弱酸溶液的 pH=4 | |
| B. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH=7 | |
| C. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH>7 | |
| D. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH<7 |
| A. | A=1×10-4B | B. | B=1×10-4A | C. | A>B | D. | A=B |
| A. | 23gNa与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转化为Fe3O4,失去8NA个电子 |
 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.