题目内容
19.反应2A(g)+B(g)?3C(g),起始时按5:2的体积比将A,B两气体混合后充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%.求:(1)A,B的转化率分别为:aA=56%,aB=70%.
(2)平衡混合气体的平均相对分子质量(设A的相对分子质量为MA,B的相对分子质量为MB):$\frac{5{M}_{A}+2{M}_{B}}{7}$.
(3)平衡时压强与起始相比,有何变化?不变(填“增大”、“不变”或“减小”).
分析 相同条件下,气体的物质的量之比等于体积之比,反应开始时A、B的体积之比为5:2,则其物质的量之比也是5:2,设反应起始时A、B物质的量分别是5mol、2mol,该反应前后气体的计量数之和不变,所以反应前后混合气体总物质的量不变,达到平衡状态时,C的体积分数是60%,则C的物质的量分数也是60%,n(C)=(5+2)mol×60%=4.2mol,
(1)根据方程式知,参加反应的△n(A)=$\frac{2}{3}$△n(C)=$\frac{2}{3}×4.2mol$=2.8mol、△n(B)=$\frac{1}{3}$△n(C)=$\frac{1}{3}×4.2mol$=1.4mol,转化率=$\frac{参加反应的物质的量}{起始物质的量}×100%$;
(2)平衡混合气体的平均相对分子质量在数值上等于其摩尔质量,平均摩尔质量=$\frac{m}{n}$;
(3)恒温恒容条件下,气体的压强之比等于物质的量之比.
解答 解:相同条件下,气体的物质的量之比等于体积之比,反应开始时A、B的体积之比为5:2,则其物质的量之比也是5:2,设反应起始时A、B物质的量分别是5mol、2mol,该反应前后气体的计量数之和不变,所以反应前后混合气体总物质的量不变,达到平衡状态时,C的体积分数是60%,则C的物质的量分数也是60%,n(C)=(5+2)mol×60%=4.2mol,
(1)根据方程式知,参加反应的△n(A)=$\frac{2}{3}$△n(C)=$\frac{2}{3}×4.2mol$=2.8mol、△n(B)=$\frac{1}{3}$△n(C)=$\frac{1}{3}×4.2mol$=1.4mol,
转化率=$\frac{参加反应的物质的量}{起始物质的量}×100%$,所以A的转化率=$\frac{2.8mol}{5mol}×100%$=56%,B的转化率=$\frac{1.4mol}{2mol}×100%$=70%,
故答案为:56%;70%;
(2)平衡混合气体的平均相对分子质量在数值上等于其摩尔质量,平均摩尔质量=$\frac{m}{n}$=$\frac{5×{M}_{A}+2×{M}_{B}}{5+2}$mol/L=$\frac{5{M}_{A}+2{M}_{B}}{7}$mol/L,所以其平均相对分子质量为$\frac{5{M}_{A}+2{M}_{B}}{7}$,故答案为:$\frac{5{M}_{A}+2{M}_{B}}{7}$;
(3)恒温恒容条件下,气体的压强之比等于物质的量之比,反应前后气体的物质的量不变,则压强不变,故答案为:不变.
点评 本题考查化学平衡有关计算,侧重考查学生分析及计算能力,注意该反应方程式特点是解本题关键,题目难度不大.

| A. | 5.6L | B. | 11.2L | C. | 16.8L | D. | 22.4L |
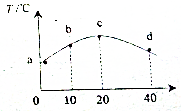 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(NO2-)+c(HNO2) | |
| C. | c点混合溶液中:c(Na+)>c(OH-)>c(NO2)>c(H+) | |
| D. | d点混合溶液中:c(OH-)=c(HNO2)+c(H+) |
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性:Na2CO3>NaHCO3 |
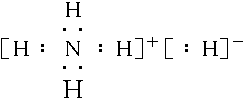 .
.
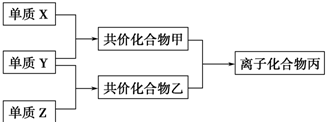
 ;
;