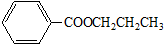题目内容
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 23gNa与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转化为Fe3O4,失去8NA个电子 |
分析 A、求出钠的物质的量,然后根据反应后1mol钠反应生成0.5mol氢气来分析;
B、铜和浓硫酸反应时,浓硫酸被还原为SO2;
C、N2和H2均为双原子分子;
D、根据Fe3O4中铁为+$\frac{8}{3}$价来分析.
解答 解:A、23g钠的物质的量为1mol,而钠与水反应时1mol钠生成0.5mol氢气,即生成0.5NA个分子,故A错误;,
B、铜和浓硫酸反应时,浓硫酸被还原为SO2,不是三氧化硫,故B错误;
C、标准状况下,22.4LN2和H2混合气的物质的量为1mol,而N2和H2均为双原子分子,故1mol混合气体中无论两者的比例如何,均含2mol原子,即2NA个,故C错误;
D、Fe3O4中铁为+$\frac{8}{3}$价,故1mol铁反应失去$\frac{8}{3}$mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.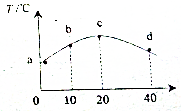 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(NO2-)+c(HNO2) | |
| C. | c点混合溶液中:c(Na+)>c(OH-)>c(NO2)>c(H+) | |
| D. | d点混合溶液中:c(OH-)=c(HNO2)+c(H+) |
5.用O2将HCl转化为Cl2,可提高效益,减少污染.

(1)传统上该转化通过如图1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H<0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol•min-1为单位,写出计算过程).
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.

(1)传统上该转化通过如图1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H<0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
12. C、N、O、Al、Si、Cu是常见的六种元素.
C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元素周期表第三周期第IVA族;
(2)N的基态原子核外电子排布式为1s22s22p3;Cu的基态原子最外层有1个电子;
(3)用“>”或“<”填空:
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动.t1时,原电池中电子流动方向发生改变,其原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al的进一步反应.
 C、N、O、Al、Si、Cu是常见的六种元素.
C、N、O、Al、Si、Cu是常见的六种元素.(1)Si位于元素周期表第三周期第IVA族;
(2)N的基态原子核外电子排布式为1s22s22p3;Cu的基态原子最外层有1个电子;
(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动.t1时,原电池中电子流动方向发生改变,其原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al的进一步反应.
9.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性:Na2CO3>NaHCO3 |


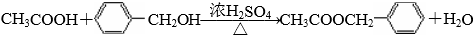 .
. .
. B.
B.