题目内容
【题目】某温度时,在2L容器中X.、Y、Z三种物质的物质的量随时间变化曲线如右图所示,由图中数据分析,
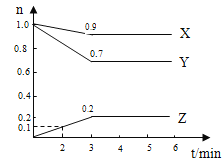
(1)该反应的化学方程式为
(2)反应开始至2min、Z的平均反应速率为 。
(3)平衡时X的体积分数为 。
【答案】(1)X +3Y![]() 2Z(2)0.025mol· L-1·min-1(3)50%
2Z(2)0.025mol· L-1·min-1(3)50%
【解析】
试题分析:(1)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,化学反应中各物质的物质的量变化量与化学计量数之比呈正比,则有Y:X:Z=(1.0mol-0.9mol):(1)0mol-0.7mol):0.2mol=1:3:2,则反应的化学方程式为X +3Y![]() 2Z。
2Z。
(2)反应开始至2min,用Z表示的平均反应速率为v=△c/△t=0.1/2×2=0.025mol.L-1.min-1。
(3)平衡时X的体积分数=0.9/(0.9+0.7+0.2)=0.5=50%.

【题目】TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
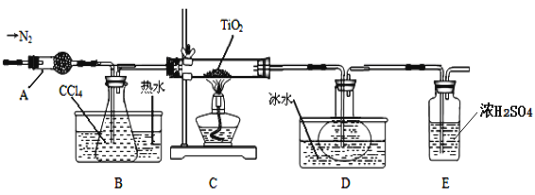
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | —23 | 76 | 与TiCl4互溶 |
TiCl4 | —25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)仪器A的名称是 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是 。
(3)装置E能否 (填“能”或“不能”)换成装置A,理由是 。
(4)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(5)写出生成TiO2·xH2O的化学方程式 。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL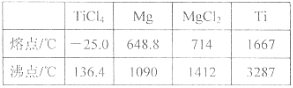 。
。
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是: 。
②该滴定操作所用到的指示剂是 。
③则TiO2质量分数为 。