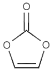
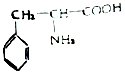题目内容
【题目】[化学一选修5:有机化学基础]布洛芬缓释高分子药物P的合成路线如下:

已知:
(1)A为一元羧酸,8.8g A与足量NaHCO3溶液反应生成2.24L CO2(标准状况),A的分子式是
。
(2)B和E的核磁共振氢谱都只有2种峰,D的系统名称是 ,E含有的官能团是 。
(3)D与过量的E反应生成F;若D过量,将得到F′。F′的结构简式是 。
(4)反应条件Ⅰ是 ,G生成P的反应类型 。
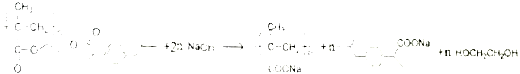
(5)P用NaOH水溶液处理的化学方程式是 。
(6)写出2种符合下列要求的布洛芬的同分导构体:①含有苯环和酯基;②其核磁共振氢谱为4组峰,且峰面积比为9:6:2:1
【答案】(1)C4H8O2 (2)2-甲基丙烯酸 羟基(3)
(4)浓硫酸△;加聚
(5)
(6)从以下6种任写两种即可,

【解析】
试题分析:
(1)8.8g一元羧酸 A与足量NaHCO3溶液反应生成0.1mol CO2,可知A的物质的量为0.1mol,可得A的相对分子质量为88,故可得分子式是C4H8O2。
(2)因C4H8O2的一元羧酸只有丁酸和2-甲基丙酸两种,结合信息可知,A→B是在羧基的邻位发生取代反应,又有B的核磁共振氢谱只有2种峰,可得A为(CH3)2CHCOOH,B为(CH3)2CClCOOH;B→C发生消去反应,可知C为CH2=C(CH3)COONa;C→D为酸化,可知D为CH2=C(CH3)COOH,即D的名称为2-甲基丙烯酸;E的核磁共振氢谱只有2种峰,且分子式为C2H6O2,可知E为乙二醇,分子中含有官能团羟基。
(3)过量的CH2=C(CH3)COOH与乙二醇反应,可以将乙二醇分子中的两个羟基都发生酯化反应,所得F′的结构简式是为 。
。
(4)D与E反应生成F,是发生酯化反应,故反应条件Ⅰ为浓硫酸,加热;G生成P的反应类型为加聚反应。
(5)P用NaOH水溶液处理的化学方程式是
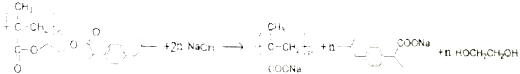 。
。
(6)符合下列要求的布洛芬的同分导构体共有6种。

【题目】Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% Fe2(SO4)3溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500 mol·L-1标准K2Cr2O7溶液进行滴定到终点。重复3次,数据记录如下表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(1)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是
______________________________。(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-===2Fe2++I2 ②______________________________。
(3)根据滴定有关数据,该废液中I-含量是_____g·L-1。
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是___________。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(5)设计实验①的目的是______________________________。
(6)实验③可得出结论是______________________________。
(7)写出实验②中反应的离子方程式______________________________。
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子____________________有关。