题目内容
【题目】A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29。回答下列问题:
(1)五种元素中第一电离能最大的是_____,其中D原子价电子排布图为______。
(2)元素B的简单气态氢化物的沸点______元素A的简单气态氢化物的沸点(填大于或小于),其主要原因是____; A的简单气态氢化物中心原子的杂化轨道类型为________。
(3)BC3-的立体构型为__________,与其互为等电子体的分子是__________(写化学式)。
(4)EC在加热条件下容易转化为E2C,从原子结构的角度解释原因____________;E原子的外围电子排布式为_____________。
(5)硼与D可形成一种耐磨材料F,其结构与金刚石相似(如图)。F的晶胞边长为a cm,则该晶体密度的表达式为___________g·cm-3。(用含a、NA的式子表示, 不必化简)。

【答案】 N 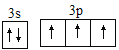 高于 NH3分子之间存在氢键 sp3 平面三角形 SO3 Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,Cu2O 更稳定 3d104s1
高于 NH3分子之间存在氢键 sp3 平面三角形 SO3 Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,Cu2O 更稳定 3d104s1 ![]()
【解析】A的一种同位素可用于考古中测定生物的死亡年代,A为C元素;C原子的最外层电子数是次外层的3倍,C为O元素;A为第二周期元素,B与A同周期,B的s能级电子数比p能级电子数多,B的原子序数介于A与C之间,B为N元素;E的原子序数为29,E为Cu元素;D与B同主族,D的原子序数介于C与E之间,D为P元素。
(1)五种元素中第一电离能最大的是N。D的价电子排布图为 。
。
(2)沸点NH3![]() CH4,主要原因是NH3分子间存在氢键。CH4中碳原子为sp3杂化。
CH4,主要原因是NH3分子间存在氢键。CH4中碳原子为sp3杂化。
(3)BC3-为NO3-,NO3-的立体构型为平面三角形。用“替代法”,与其互为等电子体的分子是SO3等。
(4)EC为CuO,E2C为Cu2O,CuO在加热条件下容易转化为Cu2O的原因是:Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,Cu2O 更稳定。Cu原子的外围电子排布式为3d104s1。
(5)用“均摊法”确定晶胞中含有的原子的个数,由晶胞的边长计算晶胞的体积,进一步计算1mol晶体的体积,1mol晶体的质量除以1mol晶体的体积计算晶体的密度。
A的一种同位素可用于考古中测定生物的死亡年代,A为C元素;C原子的最外层电子数是次外层的3倍,C为O元素;A为第二周期元素,B与A同周期,B的s能级电子数比p能级电子数多,B的原子序数介于A与C之间,B为N元素;E的原子序数为29,E为Cu元素;D与B同主族,D的原子序数介于C与E之间,D为P元素。
(1)根据同周期从左到右第一电离能呈增大趋势,第VA族大于第VIA族,第一电离能N![]() O
O![]() C,同主族从上到下第一电离能逐渐减小,第一电离能N
C,同主族从上到下第一电离能逐渐减小,第一电离能N![]() P,Cu是金属元素,Cu的第一电离能最小,五种元素中第一电离能最大的是N。D为P元素,P原子核外有15个电子,根据构造原理,基态P原子的核外电子排布式为1s22s22p63s23p3,P原子的价电子排布式为3s23p3,D的价电子排布图为
P,Cu是金属元素,Cu的第一电离能最小,五种元素中第一电离能最大的是N。D为P元素,P原子核外有15个电子,根据构造原理,基态P原子的核外电子排布式为1s22s22p63s23p3,P原子的价电子排布式为3s23p3,D的价电子排布图为 。
。
(2)B的简单氢化物为NH3,A的简单氢化物为CH4,沸点NH3![]() CH4,主要原因是NH3分子间存在氢键,CH4分子间不存在氢键。CH4中中心原子C上的孤电子对数为
CH4,主要原因是NH3分子间存在氢键,CH4分子间不存在氢键。CH4中中心原子C上的孤电子对数为![]() (4-4
(4-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,CH4中碳原子为sp3杂化。
1)=0,成键电子对数为4,价层电子对数为0+4=4,CH4中碳原子为sp3杂化。
(3)BC3-为NO3-,NO3-中中心原子N上的孤电子对数为![]() (5+1-3
(5+1-3![]() 2)=0,成键电子对数为3,价层电子对数为0+3=3,VSEPR模型为平面三角形,N上没有孤电子对,NO3-的立体构型为平面三角形。用“替代法”,与其互为等电子体的分子是SO3等。
2)=0,成键电子对数为3,价层电子对数为0+3=3,VSEPR模型为平面三角形,N上没有孤电子对,NO3-的立体构型为平面三角形。用“替代法”,与其互为等电子体的分子是SO3等。
(4)EC为CuO,E2C为Cu2O,CuO在加热条件下容易转化为Cu2O的原因是:Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,Cu2O 更稳定。Cu原子核外有29个电子,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu原子的外围电子排布式为3d104s1。
(5)B原子最外层有3个电子,P原子最外层有5个电子,B与P形成的化合物的化学式为BP,F的化学式为BP;用“均摊法”金刚石的晶胞中含C原子:8![]() +6
+6![]() +4=8个;F的晶胞中含4个B原子和4个P原子,F的晶胞边长为acm,F的晶胞体积为a3cm3;1mol晶体的体积为
+4=8个;F的晶胞中含4个B原子和4个P原子,F的晶胞边长为acm,F的晶胞体积为a3cm3;1mol晶体的体积为![]() cm3;1mol晶体的质量为42g,该晶体的密度为42g
cm3;1mol晶体的质量为42g,该晶体的密度为42g![]() (
(![]() cm3)=
cm3)=![]() g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案