题目内容
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3 会快速分解为FeBr2。某校同学设计实验用干燥的HBr 与Fe 反应制备少量FeBr2,实验装置如下(部分夹持装置已省略),请回答相关问题:
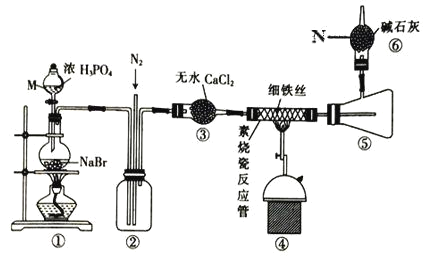
(1)仪器 M 名称是___,装置④中主要的化学方程式为__________。
(2)装置⑥的作用是___,逸出的气体主要是_____(填化学式)。
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是____。
(4)将浓磷酸换成浓硫酸同样能制得 HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制 HBr 的原因是硫酸和磷酸都具有___(填选项字母)。
a.脱水性 b.强氧化性 c.难挥发性
②溶液变橙黄色是因为发生了副反应____(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度____ (填“有”或“没有”)影响,理由是__
【答案】分液漏斗 Fe + 2HBr =FeBr2 + H2 吸收未反应的 HBr,并防止空气中的水蒸气进入装置 H2 和 N2 使装置中残留的 HBr 被充分吸收,避免造成污染 c 2NaBr+2H2SO4(浓) ![]() SO2↑+Br2↑+2H2O+Na2SO4 没有 SO2 与铁不反应,溴与铁生成的 FeBr3 在高温下迅速分解为 FeBr2。
SO2↑+Br2↑+2H2O+Na2SO4 没有 SO2 与铁不反应,溴与铁生成的 FeBr3 在高温下迅速分解为 FeBr2。
【解析】
根据装置图可知:装置①用来制备HBr,由于溴化亚铁易潮解变质,实验前需通入氮气排除装置内的空气,装置②可以起到安全瓶的作用,防止装置④中的导管发生堵塞,装置③是干燥生成的HBr气体, HBr与Fe在装置④中反应生成溴化亚铁,800℃以上溴化亚铁可升华,装置⑤收集生成的溴化亚铁,装置⑥吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤,据此答题。
(1)仪器M名称是分液漏斗,装置④中HBr与Fe反应生成溴化亚铁和氢气,化学方程式为Fe +2HBr=FeBr2+H2,故答案为:分液漏斗,Fe +2HBr=FeBr2+H2。
(2)装置⑥中装有碱石灰,能吸收水和酸性气体,其作用是除去尾气中的HBr等酸性气体并防止空气中的水蒸气进入装置⑤,逸出的气体主要是氢气和氮气,化学式为:H2和N2,故答案为:吸收未反应的HBr,并防止空气中的水蒸气进入装置;H2和N2。
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是使装置中残留的 HBr被充分吸收,避免造成污染,故答案为:使装置中残留的HBr被充分吸收,避免造成污染。
(4)①浓磷酸和浓硫酸均能用于制HBr的原因是硫酸和磷酸都具有难挥发性,故答案为:c。
②浓硫酸具有强氧化性,能够氧化溴离子生成溴单质,因此溶液变橙黄色是因为发生了副反应2NaBr+2H2SO4(浓)![]() SO2↑+Br2↑+2H2O+Na2SO4,故答案为:2NaBr+2H2SO4(浓)
SO2↑+Br2↑+2H2O+Na2SO4,故答案为:2NaBr+2H2SO4(浓)![]() SO2↑+Br2↑+2H2O+Na2SO4。
SO2↑+Br2↑+2H2O+Na2SO4。
③用浓硫酸作反应物时,进入素烧瓷反应管的HBr中含有溴蒸气和二氧化硫,SO2与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2,不会影响产品纯度,故答案为:没有;SO2与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2。