题目内容
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
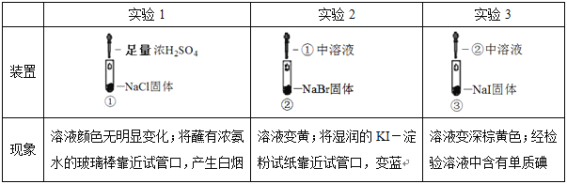
下列对实验的分析不合理的是
A.实验1中,白烟是NH4Cl
B.根据实验1、2,可以判断还原性:Br->Cl-
C.根据实验3,可以判断还原性:I->Br-
D.上述实验体现了浓硫酸的强氧化性、难挥发性等性质
【答案】C
【解析】
A、实验1中,浓硫酸与氯化钠反应生成氯化氢气体,遇到空气中的水蒸气,形成盐酸小液滴,盐酸与氨气反应生成NH4Cl固体,故A不符合题意;
B、实验1中没有发生氧化还原反应,实验2中浓硫酸将溴离子氧化生成溴,溶液变黄;因此还原性:Br->Cl-,故B不符合题意;
C、实验3中②中溶液中的浓硫酸和溴都能将碘化钠氧化生成碘,不能判断还原性:I->Br-,故C符合题意;
D、实验2中体现了浓H2SO4的强氧化性,实验1中体现了浓H2SO4的难挥发性,故D不符合题意;
故选C。

【题目】请综合运用所学知识,填写下列空白:
(1)①中和热测定实验中,除了烧杯、温度计、泡沫塑料、泡沫塑料板外,还需要使用的仪器有_____。
②下列关于中和热的说法正确的是______
A.用稀硫酸和Ba(OH)2溶液代替盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸溶液的温度后,用蒸馏水洗净再测NaOH溶液温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
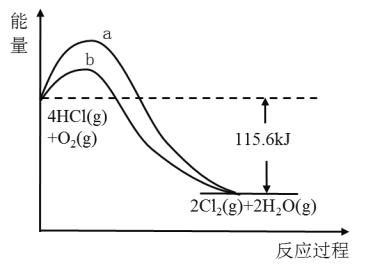
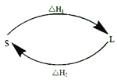
(2)①某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含任意数目的中间步骤)连接如图所示,则△H1+△H2=______。
②已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______。
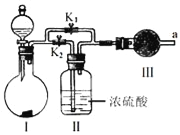
(3)①用如图所示装置,在一定条件下讨论锌与稀硫酸的反应速率时,采用一些方法测定了下列物理量,其中可以用于表示(或计算)其化学反应速率的是______
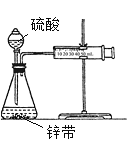
A.收集10mL H2所用的时间 B.一定时间内收集H2的体积
C.一定时间内溶液中H+的浓度变化 D.一定时间内锌粒质量的变化
E.一定时间内反应热量的变化
②为加快一定量的Zn与足量稀硫酸反应的速率,且不影响生成H2的总量,下列措施可行的是_____
A.加入少量CuSO4溶液 B.对反应液适当加热
C.将稀硫酸换成浓硫酸 D.将锌粒换成锌粉
(4)反应a M(g)+a N(g)![]() b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
开始时 | 平衡时 | |||
容器1 | 2mol M | 1mol N | 总压P1 | 0.5mol W |
容器2 | 1mol M | 2mol N | 总压P2 | x mol W |
则x=____,P1_____P2(填“>”、“<”或“=”)。