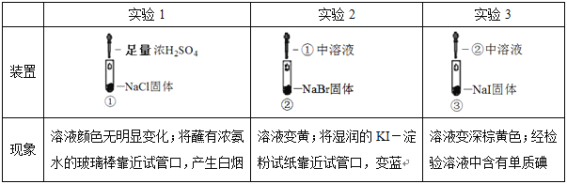
题目内容
【题目】现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是( )
A.向①中逐滴加入少量②,![]() 逐渐增大
逐渐增大
B.①、③等体积混合后溶液中存在:NH4+ +H2O![]() NH3·H2O+H+
NH3·H2O+H+
C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+ )
D.①、③按体积比2:1混合:c(NH4+)>c(NH3H2O)>c(SO42-)>c(OH-)>c(H+)
【答案】D
【解析】
A选项,向①中逐滴加入少量②,反应消耗一水合氨,生成醋酸铵,c(NH4+)增大,c(NH3H2O)减小,![]() 逐渐增大,故A正确;
逐渐增大,故A正确;
B选项,①、③等体积混合溶质KNH4SO4,溶液中铵根离子水解:NH4+ +H2O![]() NH3·H2O+H+,故B正确;
NH3·H2O+H+,故B正确;
C选项,①、②任意比混合遵循电荷守恒思想,即c(CH3COO-)+c(OH-)=c(H+)+c(NH4+),故C正确;
D选项,①、③按体积比2:1混合,溶液中溶质主要是:NH3·H2O和KNH4SO4 ,溶液主要以电离为主,因此c(NH4+)>c(SO42-)>c(NH3·H2O) >c(OH-)>c(H+),故D错误;
综上所述,答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目