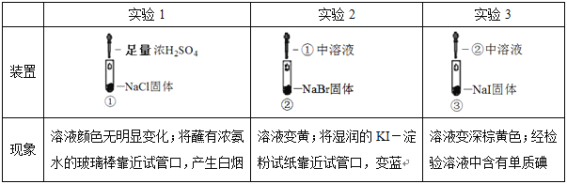
题目内容
【题目】已知A,B,C,D都是周期表中的短周期元素,它们的核电荷数依次增大。A原子,C原子的L能层中,都有两个未成对的电子,C,D同主族。E,F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号___,该能层具有的原子轨道数为__;
(2)E2+离子的价层电子排布图是__;
(3)A的最高价氧化物对应的水化物,其中心原子采取的轨道杂化方式为__,B的气态氢化物的VSEPR模型为__。
(4)DAB-的电子式为___;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6。甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为__。
【答案】M 9 ![]() sp2 四面体形
sp2 四面体形 ![]() 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
【解析】
A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素,据此分析解答。
(1)D为硫元素,S原子中有16个电子,有3个电子层:K、L、M,第三能层存在s、p、d三种轨道,分别有1、3、5个,共9个原子轨道,故答案为:M;9;
(2)E为铁元素,Fe2+离子的价层电子排布3d6,其价层电子排布图是![]() ,故答案为:
,故答案为:![]() ;
;
(3)A元素的最高价氧化物对应的水化物为碳酸,中心原子碳原子的价层电子对数为![]() =3,所以碳原子的轨道杂化方式为sp2杂化;B的气态氢化物为NH3,NH3分子中N原子价层电子对数=
=3,所以碳原子的轨道杂化方式为sp2杂化;B的气态氢化物为NH3,NH3分子中N原子价层电子对数=![]() =4,其VSEPR模型为正四面体,故答案为:sp2;四面体形;
=4,其VSEPR模型为正四面体,故答案为:sp2;四面体形;
(4)DAB-为SCN与CO2互为等电子体,二者结构相似,SCN的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)配合物甲的焰色反应呈紫色,可知其中含有 K元素,其内界由中心离子Fe3+与配位体CN构成,配位数为6,甲为K3[Fe(CN)6],甲的水溶液可以用于实验室中Fe2+离子的定性检验,检验Fe2+离子的离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓。

【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)△H=-23.5kJmol-1,该反应在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,应经过l0min后达到平衡。
Fe(s)+CO2(g)△H=-23.5kJmol-1,该反应在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,应经过l0min后达到平衡。
(1)CO的平衡转化率=__;
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是__;
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
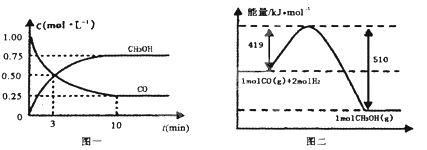
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=___;
(4)已知氢气的燃烧热286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式___;
(5)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、Q2、Q3均大于0) |
甲 | 1molCO和2molH2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1molCH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2molCO和4molH2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是___。
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α/span>1+α2=1
E.该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量
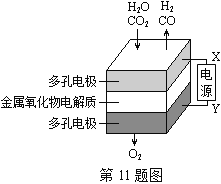
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
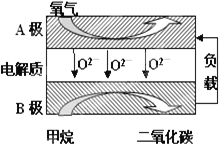
(6)B极上的电极反应式为___;
(7)若用该燃料电池做电源,用石墨做电极电解100mL1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为__(标况下)。