��Ŀ����
����Ŀ�����ۺ�������ѧ֪ʶ����д���пհף�
��1�����к��Ȳⶨʵ���У������ձ����¶ȼơ���ĭ���ϡ���ĭ���ϰ��⣬����Ҫʹ�õ�������_____��
�����й����к��ȵ�˵����ȷ����______
A.��ϡ�����Ba(OH)2��Һ����������NaOH��Һ�����к��Ȳⶨ�����ȷ�����������к�����ֵ������ͬ
B.�ⶨ�к���ʱ��Ϊ��֤����ַ�Ӧ��Ӧ������Һ�����ִε�������Һ�У�����ֽ���
C.�ⶨ�к���ʱ���¶ȼƲ���������Һ���¶Ⱥ�������ˮϴ���ٲ�NaOH��Һ�¶ȣ�ʵ��ȷ�ȸ���
D.Ϊȷ�ⶨ������NaOH��Һ��Ӧ���к��ȣ�������ͼ�����ʵ���Ӧ���
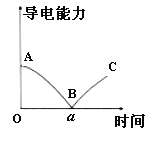
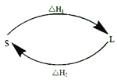
��2����ij��Ӧ���̣�������ϵ��ʼ̬ΪS����̬ΪL������֮��ı仯�����λ��ߣ�������������Ŀ���м䲽�裩������ͼ��ʾ�����H1+��H2=______��
����֪C(s)��H2(g)��CH3COOH(l)��ȼ���ȷֱ�Ϊ393.5kJ/mol��285.8kJ/mol��870.3kJ/mol����Ӧ2C(s)+2H2(g)+O2(g)=CH3COOH(l) ��H=_______��
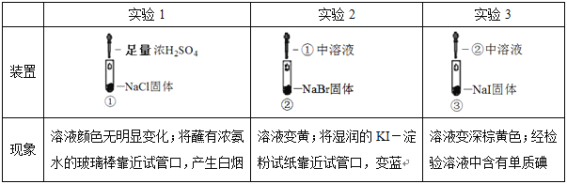
��3��������ͼ��ʾװ�ã���һ������������п��ϡ����ķ�Ӧ����ʱ������һЩ�����ⶨ�����������������п������ڱ�ʾ������㣩�仯ѧ��Ӧ���ʵ���______
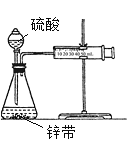
A.�ռ�10mL H2���õ�ʱ�� B.һ��ʱ�����ռ�H2�����
C.һ��ʱ������Һ��H+��Ũ�ȱ仯 D.һ��ʱ����п�������ı仯
E.һ��ʱ���ڷ�Ӧ�����ı仯
��Ϊ�ӿ�һ������Zn������ϡ���ᷴӦ�����ʣ��Ҳ�Ӱ������H2�����������д�ʩ���е���_____
A.��������CuSO4��Һ B.�Է�ӦҺ�ʵ�����
C.��ϡ���ỻ��Ũ���� D.��п������п��
��4����Ӧa M(g)+a N(g)![]() b W(g)+c Z(g)���������ͬ�Һ㶨�����������У��������з�ʽ����ԭ�ϣ�һ��ʱ���ﵽƽ�⣺
b W(g)+c Z(g)���������ͬ�Һ㶨�����������У��������з�ʽ����ԭ�ϣ�һ��ʱ���ﵽƽ�⣺
��ʼʱ | ƽ��ʱ | |||
����1 | 2mol M | 1mol N | ��ѹP1 | 0.5mol W |
����2 | 1mol M | 2mol N | ��ѹP2 | x mol W |
��x=____��P1_____P2������������������������������
���𰸡���Ͳ�����β�������� C 0 -488.3kJ/mol ABCDE BD 0.5 =
��������
��1�������к��Ȳⶨʵ������������֪������Ҫ��Ͳ�Լ����β����������
��A��ϡ����� Ba(OH)2��Һ��Ӧ�������к��������Ե�BaSO4���������ų���������������� NaOH��Һ��Ӧ�࣬������к������ݲ�һ������A����
B������к͵����ʷdz��죬���������룬�ᵼ����������ɢʧ������кͷų�����������ȫ�������ڼ�����Һ��������������ݲ�ȷ����B����
C������������ˮϴ���¶ȼƣ����¶ȼƷ���NaOH ��Һʱ���¶ȼ��ϵ��������NaOH ��Ӧ��������������������Һ�¶Ȳ�ȷ����Cȷ��
D��Ϊ�˱�֤����ȫ�кͣ�һ����Ҫ���Թ�������D����
��2����ʼ̬S����һϵ�з�Ӧ�ٻص�ʼ̬S�����ʱ�������δ�����ı䣬���ݸ�˹���ɿ�֪������ЧӦ��H1+��H2=0��
����C(s)��O2(g)=CO2(g) ��H1=��393.5kJ/mol I
H2(g)��1/2O2(g)=H2O(l) ��H2=-285.8kJ/mol II
CH3COOH(l)��2O2(g)=2CO2(g)��2H2O(l) ��H3=-870.3kJ/mol III
���ݸ�˹���ɿ�֪��2C(s)+2H2(g)+O2(g)=CH3COOH(l) ��H=��H1��2+��H2��2-��H3=-488.3 kJ/mol��
��3���ٵ�λʱ��������������ı仯�����ɱ�ʾ��ѧ��Ӧ���ʿ�����ABCDE����Ӧ�����������DZ������ɴ˿�֪��ABCDE�������������������ڱ�ʾ������㣩�仯ѧ��Ӧ���ʣ��ʴ�Ϊ��ABCDE��
��A���������� CuSO4��Һ����������Cu2��>H������Һ��Zn��Cu2����Ӧ������������Zn������H2�������٣����������⣻
B�����ȿɼӿ컯ѧ��Ӧ���ʣ���Һ���������������ı䣬������H2�������䣬�������⣻
C��Ũ������Zn��Ӧ��������H2�����������⣻
D����п������п�ۣ�����Ӵ��������ѧ��Ӧ���ʼӿ죬����H2�������䣬�������⣻�ʴ�ΪBD��
��4����Ӧ��M��N��ϵ����ͬ���ɱ������ݷ�����֪������1������2��ȫ��Ч����x=0.5��P1=P2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�