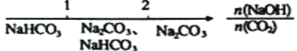题目内容
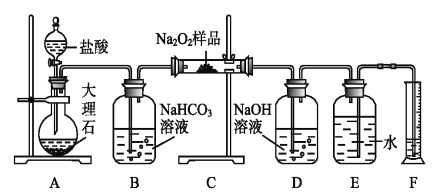
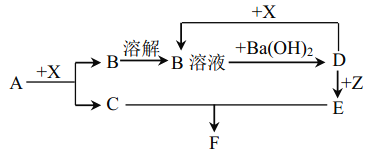
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱,F物质不溶于水。根据它们之间的转化关系(下图),回答下列问题:
(部分反应物与产物已省略)
(1)写出下列物质的化学式:X____________ F______________
(2)向Z 溶液中通入足量的Cl2,写出检验所得溶液中阳离子所需试剂_______________________。
(3)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:____________________________________________________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为_______________________。
【答案】X为 CO2 F为Fe(OH)3 硫氰化钾溶液或KSCN 避免碳酸氢钠在温度过高时分解 n(Na2CO3):n(NaHCO3)=2:1
【解析】
根据物质的颜色、状态等物理性质及物质间的转化关系分析各物质的组成;根据铁离子的检验方法分析解答;根据碳酸氢钠易分解的性质分析蒸发结晶的方法;根据原子守恒计算碳酸钠、碳酸氢钠混合物中物质的量之比。
A为淡黄色固体化合物,X为无色气体,D为一种常见的强碱,并且X与D反应生成B溶液,所以X为酸性气体,B为盐,所以不难推出A是Na2O2,X为CO2,B为Na2CO3,C是O2,B与氢氧化钡生成D,则D为NaOH,Z为浅绿色溶液,说明含有亚铁离子,亚铁离子与NaOH溶液反应生成E为Fe(OH)2,Fe(OH)2与O2、水反应生F为Fe(OH)3,
(1)通过以上分析知,X为CO2,F为Fe(OH)3,故答案为:X为 CO2 ;F为Fe(OH)3;
(2)Z为浅绿色溶液,说明含有亚铁离子,向Z溶液中通入一定量的Cl2,离子方程式为2Fe2++Cl2=2Fe3++2Cl,则检验Fe3+所需试剂为硫氰化钾溶液或KSCN,故答案为:硫氰化钾溶液或KSCN;
(3)①因为碳酸氢钠在温度过高时分解,所以蒸发结晶在低温条件下进行;
②氢氧化钠的物质的量为10g40g/mol=0.25mol,假设生成Na2CO3的物质的量为x,生成NaHCO3的物质的量为y,则根据钠原子守恒,2x+y=0.25,根据固体质量106x+84y=14.8,解得x=0.1,y=0.05,所以所得固体中含有的物质为Na2CO3和NaHCO3,它们的物质的量之比为n(Na2CO3):n(NaHCO3)=2:1;
故答案为:避免碳酸氢钠在温度过高时分解;n(Na2CO3):n(NaHCO3)=2:1。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】某小组比较Cl-、Br-、I- 的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br- D. 上述实验利用了浓H2SO4的强氧化性、难挥发性等性质