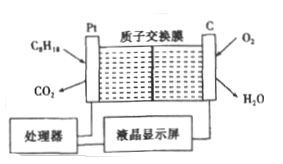
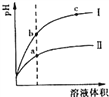
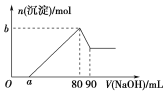
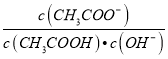题目内容
【题目】在容量瓶上无须标记的是( )
A.标线
B.温度
C.浓度
D.容量
【答案】C
【解析】解:容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,实验室常见规格有50ml、100ml、150ml、200ml、500ml等,容量瓶上标有刻度线、并标有容量,容量瓶对溶液的体积精确度要求较高,只能在常温下使用,瓶上标有使用温度,一般为25°C.故选C.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 _______。
A.c(H+)>c(OH-) B. c(H+)<c(OH-)
C.c(H+)+c(HCN) = C(OH-) D.c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA 和NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸_____________。
②b组情况表明,c_______0.2(选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)________ c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c(OH-)=______molL-1.写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)-c(A-)=______molL-1 。