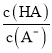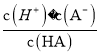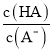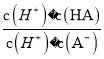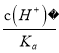题目内容
【题目】把一块镁铝合金投入到过量的1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示,下列说法中错误的是( )
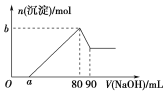
A. 盐酸的体积为90 mL
B. a的取值范围为0<a<50
C. n(Mg2+)<0.025 mol
D. 当a值为30时,b值为0.02
【答案】A
【解析】
第一阶段,盐酸和氢氧化钠反应:H++OH-=H2O;第二阶段,氯化镁、氯化铝和氢氧化钠反应Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,第三阶段,氢氧化铝溶解:Al(OH)3+NaOH=NaAlO2+2H2O,第四阶段无反应,沉淀全为Mg(OH)2,据此解答。
A、第一阶段,盐酸和氢氧化钠反应:H++OH-=H2O;第二阶段,氯化镁、氯化铝和氢氧化钠反应Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,在V(NaOH)=80mL时沉淀达到最大值,溶液中溶质全为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH)=0.08mol,所以盐酸的体积为80mL,A错误;
B、第三阶段,氢氧化铝溶解:Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH溶液体积10mL,所以第二阶段和Al3+反应的NaOH为30mL,假设无Mg2+,a=50,而实际存在Mg2+,所以0<a<50,B正确;
C、第三阶段,氢氧化铝溶解:Al(OH)3 +NaOH=NaAlO2+2H2O,因为此时消耗NaOH溶液体积为10mL,所以n(Al3+)=0.01mol,第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值,第二阶段和Al3+反应的NaOH为30mL,所以此时和Mg2+反应的NaOH为50mL,所以镁离子物质的量的最大值是0.025mol,由于a>0,所以n(Mg2+)<0.025mol,C正确;
D、a=30时,和Mg2+反应的NaOH为20mL,此时n(Mg2+)=0.01mol,b=n(Mg2+)+n(Al3+)=0.02mol,D正确。
答案选A。

【题目】现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
金属离子 | Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?________________________________,该反应的离子方程式为_________________________________。
(2)溶液II中除Cu2+外,还有______金属离子,检验试剂为______________。物质Y不能为下列的________________________。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
(3)常温下,除去CuCl2溶液中的Fe2+,加入氧化剂X,使Fe2+氧化为Fe3+,然后加入物质Y至溶液pH=4,此时c(Fe3+)=_________mol/L,[已知Fe(OH)3的Ksp=4×10-38]
(4)若在空气中加热固体CuCl2·2H2O,可水解生成Cu(OH)Cl,写出相关的化学方程式_______________________________________。