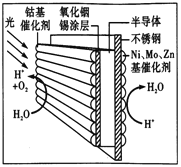
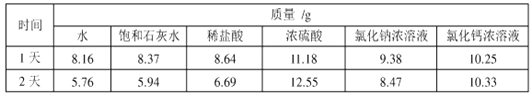
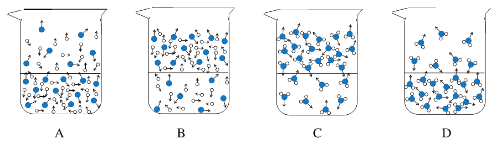
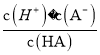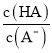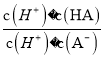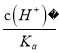题目内容
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
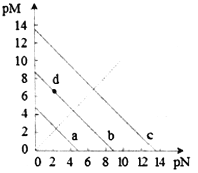
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=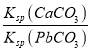
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
【答案】C
【解析】A. 由Ksp(CaSO4)=4.90×10-5得c(Ca2+)c(SO42-)=4.90×10-5,两边取负对数得:-lgc(Ca2+)- lgc(SO42-)=5-lg4.9,曲线在pN轴和pM轴上截距相等为5-lg4.9,与图中最接近的曲线为a,所以A正确;B. 在二者饱和溶液中,Ksp(CaCO)与Ksp(PbCO3)在计算中使用相同的c(CO32-),所以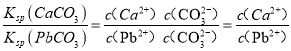 ,所以B正确;C. 由A知曲线b为Ksp (CaCO3)=2.8×10-9曲线,d点表示CaCO3的饱和溶液。且c(Ca2+)>c(CO32-),所以C错误;D. 因为Ksp (CaCO3) < Ksp(CaSO4),所以当CaSO4沉淀中加入1mol·L-1的Na2CO3溶液后,Qc> Ksp (CaCO3),则CaSO4沉淀逐渐溶解,CaCO3沉淀逐渐生成,所以D正确,故选择C。
,所以B正确;C. 由A知曲线b为Ksp (CaCO3)=2.8×10-9曲线,d点表示CaCO3的饱和溶液。且c(Ca2+)>c(CO32-),所以C错误;D. 因为Ksp (CaCO3) < Ksp(CaSO4),所以当CaSO4沉淀中加入1mol·L-1的Na2CO3溶液后,Qc> Ksp (CaCO3),则CaSO4沉淀逐渐溶解,CaCO3沉淀逐渐生成,所以D正确,故选择C。

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目