题目内容
【题目】(1)利用电化学原理,将 NO2、O2 和熔融 KNO3 制成燃料电池,模拟工业电解法来处理含 Cr2O72-废水,如下图所示;电解过程中溶液发生反应: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2 O。
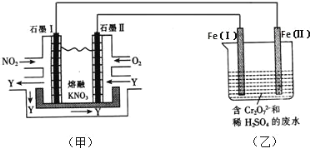
①甲池工作时,NO2 转变成绿色硝化剂 Y,Y 是 N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为______。
②向完全还原为 Cr3+的乙池工业废水中滴加 NaOH 溶液,可将铬以 Cr(OH)3 沉淀的形式除去,已知 Cr(OH)3 存在以下溶解平衡:Cr(OH)(s)![]() Cr3+(aq)+3OH-(aq),常温下 Cr(OH)3 的溶度积 K=c(Cr3+)c(3OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5molL-1,溶液的 pH 应调至___________。
Cr3+(aq)+3OH-(aq),常温下 Cr(OH)3 的溶度积 K=c(Cr3+)c(3OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5molL-1,溶液的 pH 应调至___________。
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行: Cd+2NiO(OH)+H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列问题:
①放电时,金属 Cd 作______极;
②充电时的阳极电极反应式为。_____
③充电时,当电路中通过 0.2moleˉ,阴极质量将___________(填“增加”、“减少”)___________。
【答案】O2+4e-+2N2O5=4NO3- 5 负 Ni(OH)2-e-+ OH-= NiO(OH)+ H2O 减少 3.4g
【解析】
(1) ①甲池为NO2、O2和熔融KNO3组成的燃料电池,由图示知电池工作时通入NO2的一极产生N2O5,氮元素的化合价由+4价升高到+5价,失去电子,故石墨I作负极,所以石墨II作正极;且电解质是熔融KNO3,所以通入O2和N2O5转化为NO3-,则石墨Ⅱ附近发生的电极反应为O2+4e-+2N2O5=4NO3-。
故答案为: O2+4e-+2N2O5=4NO3-;
②要使c(Cr3+)降至10-5molL-1,则此时溶液中c(OH-)= =
=![]() =10-9mol/L,c(H+)=
=10-9mol/L,c(H+)=![]() =
=![]() =10-5mol/L,pH=-lg10-5=5,即溶液的pH应调至5。
=10-5mol/L,pH=-lg10-5=5,即溶液的pH应调至5。
故答案为:5;
(2)①放电时,所给式子从左往右看,此时Cd的化合价升高,所以Cd作负极;
故答案为:负;
②充电时,所给式子从右往左看,阳极发生的氧化反应,其对应的电极反应式为:Ni(OH)2-e-+OH-= NiO(OH)+ H2O;
故答案为:Ni(OH)2-e-+OH-= NiO(OH)+ H2O;
③充电时阴极发生反应:Cd(OH)2+2e-=Cd+2OH-,阴极质量要减小,减少的质量即是生成的OH-的质量。此时得电子的物质的量与OH-的物质的量相等,所以生成的OH-的物质的量也是0.2mol,其质量为3.4g。
故答案为:减少;3.4g。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示。已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物物的沸点如下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
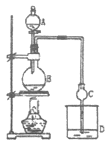
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液,经分液漏斗边滴加醋酸、边加热。
请回答:
(1)反应混合物的配制:圆底烧烧瓶中先加入___,再逐滴加入___,边加边振荡,___后,再加入醋酸。
(2)反应中加入的乙醇是过量的,其目的是___;浓硫酸的作用:①___;②___。
(3)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为___。
(4)加热除了加快反应速率外还有一个重要的目的:___。
(5)在装置中,球形干燥管主要起到两个作用:一是起冷凝作用,二是:___。
(6)试管中盛放的是饱和碳酸钠溶液,它的作用是___(选填编号)。
A.中和乙酸和乙醇 B.吸收乙酸并溶解乙醇
C.降低乙酸乙酯的溶解度,有利于析出 D.加速乙酸乙酯的生成,提高其产率
(7)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___;再加入___(此空从下列选项中选择),目的是___,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.碱石灰 B.无水硫酸钠 C.生石灰